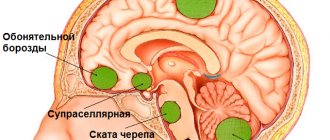
Аденома гипофиза – опухоль передней доли этой железы внутренней секреции. Болезнь чаще поражают людей в возрасте 40-45 лет. Среди всех опухолей мозга треть случаев приходится на аденому гипофиза. Микроаденома гипофиза представляет собой доброкачественное новообразование, произрастающее из железистых клеток органа, размеры которого не превышают 10 мм.
Ввиду маленьких размеров опухоли симптомы болезни при аденоме гипофиза долго отсутствуют. Врачи Юсуповской больницы выявляют опухоль с помощью современных методов исследования. Ранняя диагностика и адекватное лечение аденомы гипофиза позволяет пациентам избавиться от болезни.
Аденома гипофиза головного мозга — что это такое
Аденома гипофиза головного мозга что это такое? Аденома гипофиза – это доброкачественная опухоль, которая образуется из клеток передней доли железы внутренней секреции, играющей огромную роль в поддержании нормального гормонального баланса организма. Новообразование не имеет морфологических признаков злокачественности, но способно к прорастанию и механическому сдавливанию близлежащих к гипофизу структур головного мозга.
Болезнь аденома гипофиза проявляется зрительными, неврологическими и эндокринными нарушениями. Симптомы аденомы гипофиза головного мозга связаны с давлением растущей опухоли на внутричерепные структуры головы, которые расположены в области турецкого седла.
Если аденома гипофиза является гормонально активной, в клинической картине на первый план выходит эндокринно-обменный синдром. В этом случае изменения в состоянии пациента зачастую связаны не с самой избыточной секрецией гипофизом тропного гипофизарного гормона, а с активацией органа-мишени, на который он действует. Проявления эндокринно-обменного синдрома напрямую зависят от характера аденомы гипофиза головы.
Аденома гипофиза головного мозга может сопровождаться симптомами пангипопитуитаризма. Он развивается при разрушении тканей гипофиза растущей опухолью. Разнообразие симптомов заболевания усложняет диагностику аденомы гипофиза на ранних этапах патологического процесса.
Виды аденомы гипофиза
В Международном классификаторе болезней аденома гипофиза имеет код по МКБ-10 D35.2. По размерам опухоли различают микроаденомы гипофиза, размер которых не превышает 1см и макроаденомы. В зависимости от гормонообразующей функции опухоли выделяют гормонально активные и неактивные аденомы гипофиза. Существует несколько разновидностей активных в гормональном отношении аденом:
- Кортикотропинома – вырабатывает адренокортикотропный гормон АКТГ;
- Соматотропинома – продуцирует соматотропный гормон СТГ;
- Пролактинома – синтезирует пролактин;
- Тиротропиномой – участвует в экскреции тиреотропного гормона;
- Гонадотропинома – может продуцировать такие гормоны как фолликулостимулирующий (ФСГ) или лютеинизирующий (ЛТГ).
Онкоцитома и хромофобная аденома гипофиза относятся к гормонально неактивным новообразованиям. В зависимости от гистологического строения тканей различают следующие виды аденом гипофиза: гипофизааденокарцинома, хромофобная, базофильная, ацидофильная, ацидобазофильная или смешанная опухоль. Эндоселлярная аденома гипофиза располагается внутри турецкого седла, эндосупраселлярная – выходит на верхушку турецкого седла, эндоинфраселлярная – спускается вниз из турецкого седла, эндолатероселлярная – прорастает через боковую стенку турецкого седла. Кистозная форма аденомы гипофиза является осложнением новообразования.
Неинвазивные операции
К неинвазивным методам лечения относится стереотаксическая радиохирургия. Она является видом радиотерапии. Разница состоит в том, что пучок лучей точнее направляется на патологический участок, минимально повреждает окружающие ткани. Для получения результата нужен всего 1 сеанс, повторные назначаются лишь в отдельных ситуациях. Существует 2 вида радиохирургических установок:
- Гамма-нож (GammaKnife)
- Кибер-нож (CyberKnife)
Гамма-нож
Источник излучения в установке – кобальт-60. Пучки лучей направляются из разных точек, максимальная энергия концентрируется в патологическом участке. Точность составляет больше 0,5 мм. Вначале на голове фиксируется специальная стереотаксическая рама. Проводятся обследования (МРТ, КТ, ПЭТ-КТ), на их основе планируется облучение.
На сеансе человека укладывают на специальный стол, опять закрепляют голову. Позиционирование ручное либо автоматическое, в зависимости от установки и особенностей больного. Затем стол задвигается в аппарат. Персонал находится в другой комнате, ведет видеоуправление. Длительность — от 10 минут до нескольких часов.
Кибер-нож
Установка появилась в 90-х годах и получили много положительных отзывов. В ней используется линейный ускоритель с рентгеновскими лучами, дозы – 600-800 cGy/минуту. С помощью конусов (каллиматоров) создаются круговые поля. Они свободно перемещаются вокруг головы, выбирая самую удобную позицию для воздействия. Картинки из рентген-камеры передаются на компьютер. Потребности в фиксации головы нет, при этом точность сохраняется на уровне 0,5 мм. Существует способ применения Cyber Knife с синхронизацией. На коже прикрепляются маркеры (метки из золота и светоизлучающие волокна). Система позволяет уменьшить облучение и получить более точные изображения. После неинвазивной терапии можно в тот же день возвращаться домой. Она дополняет транссфеноидльную хирургию, когда не удается полностью удалить макроаденому. В мире есть несколько сотен таких установок. Оснащены ими и некоторые израильские клиники. Лечение опухолей мозга и соседних органов требуют большого опыта, высокоточной аппаратуры. Операции на аденоме гипофиза в Израиле успешно проводятся уже десятилетиями. Местные больницы имеют в своем распоряжении современное оборудование, а специалисты постоянно совершенствуют свои навыки, обучаются в ведущих научных центрах мира.
Причины аденомы гипофиза
Различают следующие причины развития аденомы гипофиза:
- Перенесенные или развивающиеся инфекционные заболевания головного мозга (нейросифилис, полиомиелит, менингит, энцефалит);
- Внутриутробные аномалии развития плода;
- Последствия черепно-мозговых травм.
Людей, страдающих этими заболеваниями, относят к группе риска по возможности появления у них аденомы гипофиза. К группе риска можно отнести мужчин и женщин в возрасте от тридцати до сорока пяти лет. У подростков и маленьких детей аденома гипофиза не возникает. Длительное применение оральных контрацептивов может спровоцировать развитие аденомы гипофиза у женщин.
В некоторых случаях причиной аденомы гипофиза является отягощённая наследственность. Пациентам, чьи родственники страдали этим заболеванием, нейрохирурги рекомендуют периодически проходить профилактические осмотры. Аденома гипофиза не развивается под воздействием специфических факторов риска. Возникновение опухоли не связано с условиями окружающей среды образом жизни и спецификой работы.
Степень операционного риска
Впервые операция по удалению аденомы была сделана в 1889 году Виктором Хорсли. В начале ХХ века итальянский врач Давид Джордано описал принципы транссфеноидального доступа, а в 1907 году австриец Герман Шлоффер осуществил такую операцию. В 1910 году Гирш и Холстед разработали эндоназальный и транслабиальный подходы. Сначала вмешательства проводились с помощью микроскопов. В 1965 году французский нейрохирург Дотт Гиот предложил для контроля интраоперационную флюорографию. Он также апробировал эндоскоп, но его не удовлетворила четкость изображения анатомических структур. В практику эндоскопические манипуляции при аденоме начали входить лишь в 90-х годах прошлого столетия, и сейчас почти полностью вытеснили микроскопы. Риски от операции в первые десятилетия, еще до эры антибиотикотерапии, были значительными. Летальность могла достигать 25-38%. Основной причиной были гнойные процессы. Во второй половине ХХ века качество хирургии улучшилось и процедуры стали безопасными. Способы современного удаления аденомы гипофиза:
- Трансфеноидальный
- Транскраниальный
- Неинвазивный (гамманож и кибернож)
На риски влияют:
- Размеры образования. Сложными считаются резекции гигантских аденом, с диаметром больше 5 см. Если они не диагностировались вовремя, увеличивались на протяжении десятилетий, то число осложнений доходит до 25% (при транскратниальном подходе) и 14% при транссназальном.
- Гормоны. Наиболее яркая симптоматика при адренокортикотропиноме, изменяется протеиновый и основной обмен, бывает тяжелая гипертензия.
- Возраст и здоровье больного. Вероятность неблагоприятного исхода выше после 60-ти лет, у беременных, при сопутствующих хронических заболеваниях сердца, ЖКТ, почек, эндокринной патологией, не связанной с аденомой.
- Техника вмешательства. При транссфеноидальной хирургии бывает до 2-3% осложнений. При неинвазивных – 2-4%. После трепанации черепа — 10-11%, но в ведущих клиниках сокращается до 4-6%.
- Количество операций. Аденомы гипофиза имеют склонность к рецидивам. Новые вмешательства всегда связаны с большим риском.
Смертность и тяжелая инвалидность после современных вмешательств низкая, до 0,2-0,9%.
Симптомы аденомы гипофиза
Симптомы аденомы гипофиза они наиболее часто наблюдаются у лиц молодого и трудоспособного возраста. Заболевание нередко приводят к инвалидизации пациентов. Среди клинических симптомов аденом гипофиза встречаются:
- Снижение остроты зрения;
- Слепота;
- Головные боли;
- Вегетативные кризы;
- Гипофизарная недостаточность.
Симптомом аденомы гипофиза у женщин является аменорея. У мужчин и женщин, страдающих аденомой гипофиза, может развиться нарушение либидо или репродуктивной функции. При гормонально неактивных аденомах гипофиза первые симптомы заболевания возникают по достижении больным среднего возраста. У пациентов старших возрастных групп заболевание начинается со зрительных и неврологических нарушений. У женщин до 50 лет и мужчин до 55 лет первыми симптомами аденомы гипофиза могут быть половые нарушения. У женщин внезапно развивается аменорея или нарушения менструального цикла. У мужчин первым симптомом аденомы гипофиза может быть эректильная дисфункция.
Половые нарушения преимущественно предшествуют зрительным, которые присоединяются в сроки от нескольких месяцев до 2-3 лет. Основные жалобы у пациентов, страдающих гормонально зависимой аденомой гипофиза, объединяют в 4 группы:
- Зрительные (снижение остроты зрения, ограничение полей зрения, двоение в глазах, слепота, слезотечение, жжение в глазных яблоках);
- Половые (отсутствие менструаций и нарушение менструального цикла у женщин, половые расстройства у мужчин);
- Неврологические (нарушение сна, головные боли, головокружение, снижение памяти);
- Жалобы общего характера (утомляемость, слабость, жажда, сонливость, вегетативные кризы, снижение или увеличение массы тела).
При неактивной аденоме гипофиза у 75 % пациентов имеется недостаточность экскреции тропных гормонов гипофиза. В 30% случаев определяется гипотиреоидизм, в 25% – адреналовая недостаточность. Симптомами гипогонадизма вследствие аденомы гипофиза у мужчин являются снижение либидо, эректильная дисфункция, у женщин – аменорея и бесплодие. Гипотиреоидизм проявляется следующими симптомами:
- Головной болью;
- Депрессией;
- Снижением ментальных функций;
- Запорами;
- Увеличением массы тела.
При дефиците гормона роста у взрослых пациентов снижается общая сопротивляемость, возникает ожирение, снижение минеральной плотности костей с повышенным риском переломов, появляется тревожность, беспокойство, частая смена настроения. АКТГ-недостаточность проявляется следующими признаками:
- Общей слабостью;
- Утомляемостью;
- Болями в мышцах и суставах;
- Симптомами поражения органов пищеварения;
- Нарушением сознания при вставании с постели.
Гормонально активные аденомы гипофиза выявляют в 75% пациентов. Избыточная секреция того или иного гормона в кровь приводит к развитию соответствующего клинического синдрома.
Пролактин при аденоме гипофиза повышается у пациентов, страдающих пролактиномой. Этот вид аденомы гипофиза встречается у 30 % женщин с галактореей (выделением молока из сосков) и аменореей. У мужчин пролактиномы встречаются значительно реже. Аденома гипофиза, при которой повышается уровень пролактина, проявляется определёнными клиническими симптомами: импотенцией и бесплодием у мужчин, аменореей и бесплодием у женщин. У мужчин ведущим симптомом аденомы в данном случае является снижение либидо и потенции. Затем развивается бесплодие по причине олигоспермии и остеопения. Редкими проявлениями пролактином у мужчин являются галакторея и гинекомастия (набухание грудных желез).
Соматотропинома характеризуется повышенным уровнем соматотропного гормона в крови. Такая аденома гипофиза вызывает прогрессирующее характерное изменение внешности. У пациентов увеличиваются кисти рук, стопы, укрупняются черты лица, увеличивается язык. Это может вызывать нарушение проходимости верхних дыхательных путей, синдром «ночного апноэ» – остановки дыхания во сне. При нарушении обмена веществ развивается сахарный диабет и нарушение толерантности к глюкозе. Соматотропиномы могут приводить к утолщению мышечного слоя желудочков сердца, артериальной гипертензии, аритмии, эндотелиальной дисфункции с развитием сердечной недостаточности.
Основными симптомами тиреотропиномы являются:
- Гипертиреоидизм;
- Головная боль;
- Дефекты полей зрения.
Тиреотоксикоз проявляется следующими симптомами:
- Тахикардией (учащением сердцебиения);
- Тремором (дрожанием рук);
- Повышением температуры тела;
- Экзофтальмом (пучеглазием);
- Диареей (поносом).
Кортикотропинома вызывает вторичный адреналовый гиперкортицизм, который известен как болезнь Кушинга. У пациентов лицо становится лунообразным, происходит скопление жировой ткани по задней поверхности шеи и над ключицами. Кожа истончается, появляются точечные кровоизлияния и красно-бардовые растяжки на туловище. Развивается мышечная дистрофия, миопатия, остеопороз, кифоз. У пациентов возникают патологические переломы, развивается катаракта и сахарный диабет. Вследствие иммунологических нарушений происходит грибковое поражение, возникают акне, раны долго не заживают. Вследствие развития гормональных нарушений у мужчин снижается либидо, возникает эректильная дисфункция, олигоспермия. Частыми симптомами этого вида аденомы гипофиза у женщин являются олигорея или аменорея, гирсутизм (усиленное оволосение лица и конечностей), акне.
Стандарт
В стандартном случае процедура проводится через односторонний эндоназальный доступ с эндоскопом как единственным инструментом визуализации без использования микроскопа или носорасширителя, при этом хирургические инструменты вводятся через ту же половину полости носа, что и эндоскоп. В течение процедуры ригидный эндоскоп удерживается хирургом в недоминантной руке или может быть зафиксирован с помощью специального держателя к операционному столу. Отказ от использования носорасширителя позволяет осуществлять широкие по амплитуде движения инструментами во время операции во всех направлениях, не ограниченные жесткими браншами расширителя. При крупном размере опухоли, особенно при наличии латероселлярного распространения, рекомендуется использовать двусторонний эндоскопический доступ (через обе половины носа), позволяющий свободно работать в четыре руки (рис. 4).
Рис. 4. Моменты операции. а — расположение операционной бригады; б — работа через обе половины носа «в четыре руки».
Операция состоит из нескольких этапов: назального, сфеноидального, селлярного, экстраселлярного и этапа пластики послеоперационных дефектов.
На назальном этапе
осуществляется доступ к передней стенке основной пазухи путем латерализации средней носовой раковины и устранения прочих анатомических преград (искривленная перегородка носа, костные шипы перегородки, полипы). После визуализации главного анатомического ориентира данного этапа операции — соустья основной пазухи производится коагуляция слизистой сфеноэтмоидального кармана, что приводит к обнажению костной передней стенки основной пазухи.
На сфеноидальном этапе
производятся резекция задних отделов перегородки носа и максимально широкая передняя сфеноидотомия с использованием дрели или костных кусачек. Далее резецируются мешающие доступу межпазушные перегородки. После удаления межпазушных перегородок становятся видны ключевые анатомические ориентиры основной пазухи — дно турецкого седла, площадка основной кости, скат, костные выступы внутренних сонных артерий, костные выступы зрительных нервов, оптико-каротидный карман.
На селлярном этапе
операции трепанируется дно турецкого седла, рассекается ТМО и удаляется опухоль из полости турецкого седла. Удаление опухолей гипофиза должно производиться последовательно. В первую очередь удаляется нижняя и латеральные части опухоли (но не латероселлярная) из полости турецкого седла. Удаление этих частей опухоли производится с использованием 0 и 30° эндоскопов.
Во время экстраселлярной
фазы
опухоль удаляется из супраселлярного и параселлярных пространств. На этом этапе становится необходимым последовательно использовать 30, 45, 70° эндоскопы. При использовании эндоскопов с различными углами зрения возможна широкая визуализация эндо-, супра-, латероселлярных структур в условиях хорошей освещенности операционной раны. Это позволяет снизить риск повреждения основных анатомических структур, максимально радикально удалить опухоль, в том числе и из труднодоступных мест, своевременно выявить интраоперационную ликворею и надежно закрыть дефект в капсуле. Этапы операции представлены на рис. 5.
Рис. 5. Этапы стандартной эндоскопической эндоназальной операции удаления аденомы гипофиза. а — латерализация средней носовой раковины (правосторонний доступ): 1 — средняя носовая раковина, 2 — перегородка носа, 3 — шпатель; б — коагуляция слизистой сфеноэтмоидального кармана: 1 — передняя стенка основной пазухи, 2 — верхняя носовая раковина, 3 — перегородка носа, 4 — средняя носовая раковина; в — передняя сфеноидотомия: 1 — дно турецкого седла, 2 — остатки передней стенки основной пазухи; г — анатомические ориентиры основной пазухи: 1 — костные выступы внутренних сонных артерий, 2 — дно турецкого седла, 3 — костные выступы канала зрительных нервов, 4 — оптико-каротидный карман, 5 — площадка основной кости, 6 — скат, 7 — межпазушная перегородка; д — удаление аденомы гипофиза. 0° эндоскоп: 1 — опухоль (аденома гипофиза), 2 — кюретка, 3 — отсос; е — вид супраселлярной капсулы после удаления опухоли. 70° эндоскоп: 1 — истонченная капсула в межневральном пространстве — нет явных остатков опухоли, 2 — проекция правого зрительного нерва, 3 — проекция хиазмы.
Для расправления перерастянутой супраселлярной капсулы опухоли используется методика управляемой внутричерепной гипотензии, путем выведения ликвора через установленный в начале операции наружный люмбальный дренаж, а также приподниманием головного конца операционного стола и использованием гипертонического раствора NaCl.
Неоценимо использование эндоскопической техники для удаления вторичных узлов опухоли, отходящих от ее супраселлярного отдела, а также от верхнего полюса кавернозных синусов. С эндоскопом практически всегда удается найти вход во вторичный узел и радикально удалить его. Для остановки кровотечения (как из полости кавернозного синуса, так и из полости удаленной опухоли) применяются все доступные средства для местного гемостаза: ватники, смоченные перекисью водорода, гемостатическая марля Surgicel ETHICON, Inc, пластины Tachocomb «Nycomed», Surgiflo ETHICON, Inc, эндоназальная моно- и биполярная коагуляция. Однако рекомендуется избегать использования без крайней на то нужды коагуляции в полости турецкого седла и супраселлярного пространства, а также в полости кавернозного синуса (особенно монополярной). К сожалению, широко распространенные за рубежом эффективные средства местного гемостаза (Tissuflease «Baxter» и др.) в Российской Федерации пока не сертифицированы и в настоящее время недоступны.
Интраоперационная ликворея является не осложнением, а лишь особенностью операции. Довольно частое выявление интраоперационных ликворей происходит в результате более радикального удаления опухоли и лучшей, по сравнению с микроскопом, визуализацией даже небольшой ликворной фистулы.
На этапе пластики послеоперационных дефектов полость седла герметизируется с использованием различных клеевых субстанций для профилактики послеоперационной ликвореи. Рекомендуется во всех случаях удаления аденом гипофиза для профилактики послеоперационной ликвореи (даже при отсутствии интраоперационной ликвореи) герметизировать полость турецкого седла, используя пластины Tachocomb Baxter в сочетании с фибрин-тромбиновым клеем (EviselETICON или его аналоги). Ауто-ткани используются при герметизации обширных дефектов основания черепа, в первую очередь при осуществлении расширенных эндоскопических доступов, а также при значительных дефектах супраселлярной капсулы либо при ее полном отсутствии.
При значительном отклонении супраселлярной части аденомы гипофиза на площадку основной кости удаление опухоли через дно турецкого седла будет заведомо нерадикально и сопряжено с высоким риском повреждений анатомических сосудисто-нервных структур. В этих случаях производится расширение зоны трепанации на площадку основной кости, т. е. осуществляется передний расширенный транссфеноидальный эндоскопический эндоназальный доступ (рис. 6).
Рис. 6. Схема и примеры опухолей, удаленных из переднего расширенного транссфеноидального эндоскопического эндоназального доступа (краниофарингиомы, менингиомы, аденомы гипофиза, глиомы, холестеатомы). Слева — анатомический препарат, показывающий границы переднего расширенного доступа (желтый пунктир). Зеленым пунктиром показана трепанация дна турецкого седла при стандартном трансназальном доступе. 1 – интракавернозная часть ВСА; 2 – площадка основной кости; 3 – турецкое седло; 4 – скат. Справа — пример эндосупраселлярной аденомы гипофиза, удаленной из переднего расширенного транссфеноидального эндоскопического эндоназального доступа. На МРТ до операции (сверху) видна эндосупраселлярная аденома больших размеров, супраселлярный отдел которой заваливается кпереди на площадку основной кости (указано стрелкой). МРТ через 1 год после операции (внизу). Остатков опухоли нет. В области основной пазухи имеются послеоперационные изменения.
При значительном латероселлярном распространении аденомы в полость кавернозного синуса, особенно при медиальном смещении интракавернозной части внутренней сонной артерии, в ряде случаев целесообразно, помимо трепанации дна турецкого седла, между бугорками сонных артерий осуществлять резекцию костей передней стенки кавернозного синуса латеральнее сонной артерии (так называемый латеральный расширенный транссфеноидальный эндоскопический эндоназальный доступ, (рис. 7). Этот доступ можно рассматривать как альтернативу достаточно травматичному интра-экстрадуральному интракраниальному доступу по Доленсу. Существует несколько вариантов расширенных латеральных доступов к кавернозному синусу: с резекцией только средней носовой раковины; с резекцией средней, верхней носовых раковин и задних клеток решетчатого лабиринта; латеральнее средней носовой раковины с резекцией группы передних, средних и задних решетчатых клеток. При этом доступе показано применение микродопплерографического датчика для лоцирования интракавернозной части ВСА.
Рис. 7. Схема латерального расширенного транссфеноидального эндоскопического эндоназального доступа и пример аденомы гипофиза, удаленной из данного доступа. Слева — анатомический препарат, в центре — интраоперационное фото, показывающие границы латерального расширенного доступа (желтый пунктир). Зеленым пунктиром показана трепанация дна турецкого седла при стандартном трансназальном доступе. Красная изогнутая линия — интракавернозная часть левой ВСА. 1 — интракавернозная часть ВСА; 2 — турецкое седло; 3 — скат. Справа — пример эндолатероселлярной аденомы гипофиза, удаленной из латерального расширенного транссфеноидального эндоскопического эндоназального доступа. МРТ до и через 1 год после операции (положение левой ВСА указано стрелкой).
Расширенные транссфеноидальные доступы являются достаточно сложными и должны осуществляться нейрохирургами с большим опытом эндоскопической эндоназальной хирургии, который выражается в наличии у операционной бригады специ-фических навыков и четкого понимания эндоназальной эндоскопической анатомии [13—16].
Транскраниальная хирургия аденом гипофиза
В настоящее время доля транскраниальных операций в хирургии аденом гипофиза составляет менее 10%. Сформулировать жесткие показания к транскраниальному доступу в настоящее время сложно, ибо во многом это зависит от того, насколько в каждой клинике освоены и внедрены современные транссфеноидальные эндоскопические эндоназальные операции [1].
Стандарт
Консервативное лечение аденом гипофиза
Медикаментозное лечение можно разделить на три вида [1, 5, 7, 9].
Патогенетическая терапия
. Осуществляется препаратами, ингибирующими гиперсекрецию тропных гормонов гипофиза. Данные препараты применяются в качестве комбинированного лечения СТГ-продуцирующих или смешанных СТГ+ПРЛ-секретирующих аденом гипофиза (аналоги соматостатина, агонисты дофамина, агонисты рецепторов гормона роста) или в качестве первичного метода лечения ПРЛ-секретирующих аденом гипофиза (агонисты дофамина).
Симптоматическая терапия
. Проводится в целях лечения различных синдромов, сопутствующих основным проявлениям заболевания.
Заместительная гормональная терапия
. Применяется для компенсации эндокринной недостаточности у больных с аденомами гипофиза.
Результаты хирургического лечения аденом гипофиза
Методика эндоскопического эндоназального транссфеноидального удаления аденом гипофиза позволила решить основную проблему транссфеноидальной хирургии — отсутствие панорамного обзора операционного поля. Внедрение эндоскопических технологий обеспечивает широкий обзор зоны вмешательства в условиях хорошей освещенности, позволяет удалять опухоли под непосредственным визуальным контролем. Эти факторы привели к повышению показателей радикальности и снижению риска повреждения важных анатомических образований [2—4, 10, 11, 14].
Для суждения о результатах хирургического лечения оцениваются следующие показатели: динамика основных клинических синдромов (нейроофтальмологическая симптоматика, неврологический и гормональный статус), радикальность операции, частота и характер послеоперационных осложнений, послеоперационная летальность, количество рецидивов заболевания и т. д.
Улучшение зрительных функций после операции отмечено у 32% пациентов с аденомами гипофиза [3, 4]. После эндоскопических эндоназальных операций ухудшение зрительных функций к моменту выписки отмечено лишь у 2% пациентов [3, 4].
Исследование гормонального статуса у пациентов с повышенным до операции уро
- Журналы
- Подписка
- Книги
- Рекламодателям
- Доставка / Оплата
- Об издательстве
- Контакты
- Политика конфиденциальности
- Издательство «Медиа Сфера»
Регистрация
- Телефон
- +7 (495) 482-4118
- +7 (495) 482-0604
- +8 (бесплатный номер по вопросам подписки)
- Почтовый адрес
- Издательство «Медиа Сфера»,
- а/я 54, Москва, Россия 127238
- Электронная почта
- [email protected]
- © 1998-2021
+7 (495) 482-4118, +7 (495) 482-0604
- а/я 54, Москва, Россия 127238″Издательство «Медиа Сфера» «
- [email protected]
© 1998-2021
- Издательство «Медиа Сфера»
Подтверждение e-mail
На отправлено письмо с ссылкой для подтверждения e-mail. Перейдите по ссылке из письма, чтобы завершить регистрацию на сайте.
Подтверждение e-mail
Войдите на сайт, используя вашу учетную запись в одном из сервисов
Регистрация для юридических лиц
Войти
Зарегистрироваться
Диагностика аденомы гипофиза
Диагноз «аденома гипофиза» врачи Юсуповской больницы устанавливают на основании:
- Жалоб пациента;
- Осмотра;
- Данных лабораторных и инструментальных методов исследования.
Точная диагностика имеет большое значение для выбора тактики лечения. Онкологи Юсуповской больницы учитывают возрастные изменения референтных значений уровня гормонов гипофиза. В 11-19 лет нормальная концентрация соматотропного гормона варьирует от 0,6 до 11,2 мМЕ/л у женщин и от 2,5 до 12,2 мМЕ/л у мужчин. После 19 лет референтные значения меньше 10 мМЕ/л у представителей обоих полов.
Референтное значение соматомедина С в возрасте 30-35 лет находится в пределах 125–311 нг/мл, а после 60 лет – от 93–224 нг/мл. Концентрация фолликулостимулирующего гормона у мужчин после 21 года равна 0,95–11,95 мЕд/мл, у женщин зависит от фазы менструального цикла. У детей старше 14 лет референтные значения тиреотропного гормона находятся в диапазоне 0,4–4,0 мМЕ/л. Комплексная точная диагностика аденомы гипофиза позволяет врачам Юсуповской больницы быстро идентифицировать заболевание и начать эффективную терапию.
Лабораторная диагностика при аденоме гипофиза
Лабораторную диагностику проводят с помощью качественных реактивов и современных методик исследования. Она необходима для определения гормональной активности аденомы гипофиза, постановки диагноза и последующего контроля проводимого лечения. Пациентам определяют уровень следующих гормонов:
- Пролактина;
- Соматотропина;
- Адренокортикотропина;
- Лютеинизирующего и фолликулостимулирующего;
- Тиреотропного;
- Кортизола, тироксина, тестостерона, эстрадиола.
Обязательным исследованием является определение инсулиноподобного фактора роста-1.
Методы инструментальной диагностики аденом гипофиза
Диагностику аденом гипофиза в Юсуповской больнице проводят с помощью современных инструментальных методов:
- Краниографии;
- Компьютерной и магнитно-резонансной томографии;
- Мультиспиральной томографии;
- Других методов лучевой диагностики;
- Исследования полей зрения.
Визуализация аденом гипофиза проводится с помощью лучевых методов диагностики. Врачи определяют размеры и структуру гипофиза, величину, состояние стенок «турецкого седла» и окружающих тканей. Для того чтобы избежать диагностических ошибок, в Юсуповской больницы перед тем, как сделать компьютерную (КТ) или магнитно-резонансную томографию (МРТ), выполняют краниографию. Томографию осуществляют с применением методики «усиления». В трудных диагностических случаях КТ или МРТ проводят в динамике.
С помощью краниографии определяют размеры и состояние стенок «турецкого седла» (структуру, толщину, двухконтурность, распространённость изменений). Ведущим методом диагностики аденом гипофиза является магнитно-резонансная томография. МРТ не позволяет отличить различные гормонально активные аденомы друг от друга и от гормонально неактивных.
Во время КТ-исследования при микроаденомах гипофиза врачи Юсуповской больницы используют методику «усиления» изображения. С помощью компьютерной томографии проводят дифференциальную диагностику аденом гипофиза с образованиями, которые содержат кальцинаты или гиперостозы. Использование спиральной компьютерной томографии с болюсным введением контрастного вещества по сосудистой программе позволяет врачам Юсуповской больницы изучать сосудистую сеть селлярной и параселлярной области. При нативных томографических исследованиях аденом гипофиза с супраселлярным ростом проводят дигитальную субтракционную ангиографию сосудов головного мозга или спиральную компьютерную томографию. Для выявления хиазмального синдрома определяют поля зрения.
Опухоли гипофиза. Врач-нейрохирург Лещинский Андрей Владиславович.
Краткое содержание:
- Что такое гипофиз.
- Опухоли гипофиза и их размеры.
- Магнитно-резонансная томография (МРТ)
- Алгоритм при подозрении на опухоль хиазмально-селлярной области.
- Бывают гормонально активные опухоли и гормонально неактивные.
- Клиническая картина акромегалии.
- Клиническая картина гиперкортицизма.
- Клиническая картина гормонально неактивных аденом.
- Показания к операции.
- Хирургическая техника удаления различного вида аденом.
- Клинические случаи из практики.
- Показания к радиохирургии.
Здравствуйте, уважаемые слушатели!
Я хотел бы представить доклад по поводу хирургии аденомы гипофиза
.
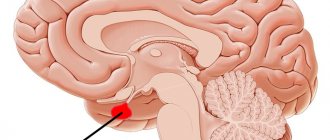
Я сам врач-нейрохирург, оперирую опухоли гипофиза. Хиазмально-селлярная область — это место, где находится гипофиз и патологические процессы, которые исходят из него.
Гипофиз
— это центральный орган эндокринной системы, который регулирует весь гормональный обмен в организме.
Когда я объясняю пациентам по поводу того, что это такое, я обычно говорю, что гипофиз — это как генерал, который контролирует все железы внутренней секреции, выделяя соответствующие гормоны.
Гипофиз состоит из нескольких долей.
- Главная — это передняя доля гипофиза, из которой собственно и вырастает аденома гипофиза. В передней доле вырабатываются соответствующие гормоны, про которые вам, возможно, уже сказали — это адренокортикотропный (АКТГ); тиреотропный (ТТГ); пролактин, фолликулостимулирующий (ФСГ); лютеинизирующий (ЛГ); соматотропный (СТГ); пролактин; ß,γ — липотропные гормоны (ЛПГ)
Некоторые гормоны действуют на весь организм, некоторые только прицельно на какие-то органы-мишени.
- Промежуточная доля: меланоцитостимулирующий гормон (МСГ)
- В задней доле гипофиза находится хранилище, депо для хранения гормонов вазопрессина и окситоцина.
Нам это важно знать с той точки зрения, что во время операции, иногда в послеоперационном периоде возможно такое осложнение, как несахарный диабет
. Человек много мочится и много пьет. Обычно это преходящее состояние.
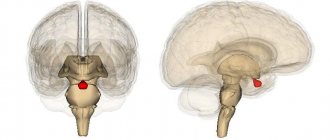
Подробно про анатомию я вам рассказывать не буду, просто скажу, что вот на рисунках красным кружочком обозначено место, где хирург производит операцию
.
Рис.1 и 2. Нормальная
анатомия хиазмально-селлярной области. МРТ
Вот это гипофиз, вот это хиазма, между ними ножка гипофиза или стебель гипофиза. Это нормальная анатомия.
Рис. 3 и 4. Аденома гипофиза. МРТ
На рисунках 3 и 4 показана патологическая анатомия. Из этого маленького органа выросла вот такая большая аденома гипофиза.
Рост опухоли может быть кверху, он называется супраселлярный, может быть книзу, он называется инфраселлярный. Может быть кзади — ретроселлярный, кпереди — антеселлярный. Или вправо или влево — это называется латероселлярный рост в соответствующую сторону, вправо или влево.
Доступ осуществляется через полость носа, если мы говорим про трансназальный подход. Далее хирург попадает в такую воздухоносную пазуху. Это полость в кости, которая называется основная кость. В ней внутри есть некоторые перегородки. Хирург их убирает и оказывается перед турецким седлом. Турецкое седло — это костный карман, в котором как раз находится гипофиз. То есть хирург делает как бы трепанацию вот здесь вот, убирает косточку, и вот здесь. И попадает в то место, где производится оперативное лечение.
Рис. 5 и 6 Компьютерная томография головного мозга
До этого была магнитно-резонансная томография головного мозга. Это компьютерная томография головного мозга. Просто еще раз хочу показать. Доступ осуществляется через полость носа. Это передняя стенка пазухи. Черное — это воздух. Это задняя стенка пазухи. И хирург оказывается в области турецкого седла. Иногда внутри пазухи существуют дополнительные перегородки.
По размерам
нам важно знать, что бывает:
- Микроаденома – до 15 мм
- Небольшая – от 16 до 25 мм
- Cредняя – от 26 до 35 мм
- Большая – от 36 до 59 мм
- Гигантская – 60 мм и более
Главное, чтобы размер был минимум в двух проекциях измерен.
Рис.7 Примеры гигантских аденом гипофиза
Вот гигантская аденома гипофиза с супраселлярным ростом кверху, с инфраселлярным ростом книзу. Тут латероселлярный рост в одну из сторон (вправо). И также видите, какой огромный узел. Все это можно удалить.
Золотой стандарт в диагностике аденом гипофиза
— это, конечно же,
магнитно-резонансная томография
. Но, конечно же, иногда назначают рентгенографию черепа, компьютерную томографию. Но по ним с точностью поставить диагноз, к сожалению, невозможно.
Рис. 8 Рентгенография черепа (оценка турецкого седла)
Рис. 9 Компьютерная томография
По компьютерной томографии: мы специально иногда ее назначаем, с той точки зрения, чтобы посмотреть, не разрушены ли костные структуры, потому что на КТ очень хорошо видны именно костные структуры.
Рис. 10 МРТ с контрастным усилением
Но, тем не менее, золотой стандарт, как я уже сказал, — это МРТ, обязательно с контрастным усилением. На рисунке 10: серое — это опухоль, а эта часть — нормальный гипофиз. Показана стрелкой опухоль. Особенно это актуально для микроаденом гипофиза, которые находятся в толще нормального, неизменённого гипофиза, и которые иными способами выявить невозможно. Это характерно для гормонально активных опухолей, например.
При подозрении на опухоль хиазмально-селлярной области существует следующий
алгоритм
:
- консультация офтальмолога;
- консультации эндокринолога с гормональным профилем, со сдачей соответствующих гормонов;
- при визуализации процесса только по КТ, обязательно МРТ головного мозга, как я сказал ранее;
- при необходимости — консультация лор-врача, санация придаточных пазух носа. Вы должны понимать, что если есть хоть какой-то воспалительный процесс носовой полости, операцию, по крайней мере, через нос, выполнить невозможно и нельзя. Поэтому врача тут нельзя обманывать в таких случаях.
- консультация нейрохирурга.
Бывают гормонально активные опухоли и гормонально неактивные.
Лечение аденомы
Как лечить аденому гипофиза? Пациентов, страдающих аденомой гипофиза, в Юсуповской больнице находятся под наблюдением эндокринолога и нейрохирурга. Они коллегиально определяют тактику лечения. Сложные случаи аденомы обсуждают на заседании Экспертного Совета с участием профессоров и врачей высшей категории. В настоящее время применяют консервативные и оперативные методы лечения заболевания.
Для лечения аденом гипофиза лучевая терапия применяется в качестве вспомогательным методом. Основными установками, которые применяют для удаления опухоли, являются:
- Гамма-нож;
- Линейный ускоритель;
- Кибер-нож;
- Протонный ускоритель.
Если выявлена аденома гипофиза у женщин, лечение проводят совместно с гинекологом и репродуктологом. Мужчин консультирует андролог.
Медикаментозная терапия аденом гипофиза
Основными препаратами для лечения пролактином и гиперпролактинемического синдрома является бромокриптин (парлодел) и каберголин. Эти препараты активно влияют на кругооборот дофамина и норадреналина в центральной нервной системе уменьшают выделение серотонина. Бромокриптин оказывает стимулирующее действие на дофаминовые рецепторы гипоталамуса. Он тормозит секрецию гормонов передней доли гипофиза, особенно соматотропина и пролактина и соматотропина.
Внутренний дофамин тормозит выработку этих гормонов. Синтеза пролактина бромокриптин не нарушает. Препарат способствует обратному развитию аденом гипофиза различных размеров, уменьшает продукцию пролактина. Бромокриптин применяют для лечения пролактином различных размеров и в качестве предоперационной терапии.
При малосимптомном течении соматотропином у пациентов пожилого возраста проводят лекарственную терапию препаратами, которые являются аналогами соматостатина (октреотидом) и антагонистами соматотропиновых рецепторов (пегвизомантом). Если пациенту по показаниям выполнено удаление аденомы гипофиза и после операции сохраняется высокая концентрация соматотропного гормона, возникает рецидив опухоли, после лучевой терапии продолжают приём лекарственного препарата. При наличии противопоказаний к оперативному вмешательству по поводу аденомы гипофиза проводят облучение и лекарственную терапию.
Целью медикаментозного лечения кортикотропином является нормализация уровня гормонов коры надпочечников в крови. Это достигают применением препаратов, которые тормозят продукцию кортизола. Также проводится симптоматическое лечение, которое направлено на коррекцию нарушений белкового и углеводного обмена, лечение сердечной недостаточности, нормализацию уровня артериального давления. Облучение аденомы гипофиза применяют для лечения кортикотропином как дополнение к оперативному вмешательству, так и в качестве первично-лучевого лечения.
Операция по удалению аденомы гипофиза
При тиреотропиноме (аденоме гипофиза головного мозга) операция является основным методом лечения. Медикаментозная терапия ограничивается поддержанием нормального уровня гормонов после операции. При болезни Кушинга выполняют хирургическое удаление аденомы гипофиза. При микроаденомах эффективность хирургического лечения достигает 70-90 %, при макроаденомах — 50-60 %. Операцию по поводу гонадотропиномы выполняют при выраженных клинических проявлениях заболевания.
В настоящее время хирургическое лечение аденом гипофиза осуществляется основными доступами: трансназосфеноидальным (трансназальным, транссфеноидальным) и транскраниальным (интрадуральным и экстрадуральным). Нейрохирурги используют эти доступы в качестве двух последовательных этапов. Трансназальное удаление аденомы проводится через нос. Методом выбора при лечении аденом гипофиза являются транссфеноидальные хирургические вмешательства. Транскраниальный метод используют при невозможности применения транссфеноидального.
Врачи Юсуповской больницы применяют микрохирургический и эндоскопический транссфеноидальный доступ. Применяют методику микроскопического удаления аденом гипофиза со вспомогательным эндоскопическим контролем, используя такие преимущества эндоскопии:
- Мощное освещение;
- Феномен эндомикроскопии;
- Наличие бокового обзора.
Это позволяет хирургу во время операции определить границы аденомы гипофиза, оценить локализацию и размеры оставшихся неудаленных фрагментов опухоли. Боковой обзор эндоскопа позволяет удалить опухоль с оптимальной стороны, избежать повреждения головного мозга, содержимого кавернозных синусов. При истечении спинномозговой жидкости её устанавливают и ликвидируют по ходу операции. Прогноз в этом случае хороший. Стоимость операции аденомы гипофиза зависит от метода оперативного вмешательства, необходимого лекарственного сопровождения дооперационного и послеоперационного периода.
Клиническая картина гиперкортицизма:
- Артериальная гипертония
- Диспластическое ожирение
- Трофические изменения кожи
- Гирсутизм
- Системный остеопороз
- Энцефалопатия
- Вторичный гипогонадизм
- Вторичный иммунодефицит
- Миопатия
- Нефролитиаз
- Стрии
- Отёки
- Симптоматический сахарный диабет
- Акне
Исходя из того, что бывают опухоли гормонально активные, существуют частные показания к операции.
Для кортикотропином, про которые я только что сказал, это болезнь Иценко-Кушинга.
Соматотропиномы — это синдром акромегалии, в качестве первого этапа, иногда при отсутствии эффекта от медикаментозного лечения. Но хирургия все-таки является помощью первой линии.
Пролактинома — при отсутствии эффекта от медикаментозного лечения, при непереносимости препаратов, аллергической реакции, например, на них. Все-таки мы считаем, что первая линия лечения — это медикаментозное лечение. Иногда бывают случаи, когда очень поздно выявили пролактиному у пациента. Она большого или гигантского размера. Очень сильно сдавила окружающие структуры мозга, вызвала, например, нарушение зрения, называется хиазмальный синдром. В этом случае совместно с эндокринологом проводится консилиум и в определенных ситуациях мы отказываемся от медикаментозной терапии, по крайней мере дооперационной, и берем сразу на операцию.
Тиреотропиномы и гонадотропиномы — это редкий вариант опухоли. Их не будем пока обсуждать.
Клиническая картина гормонально неактивных аденом
состоит из воздействия массы опухоли на окружающие структуры.
Так как опухоли не выделяют гормоны, пациенты начинают чувствовать, или почувствуют ее намного позже, чем гормонально активные опухоли.
При этом возникает так называемый хиазмальный синдром
. Это сужение полей зрения. Снижение остроты зрения. То есть возникают зрительные нарушения. Опухоль преодолевает пустое пространство между аденомой и зрительными нервами, между гипофизом и зрительными нервами и вызывает их сдавление. Может быть нарушение глазодвигательных нервов, то есть нервов, отвечающих за движение глаз. Иногда возможен экзофтальм — выбухание глаза наружу.
Половые нарушения
: аменорея, олигоопсоменорея, лакторея, бесплодие, эректильная дисфункция у мужчин.
Также возможны разного рода неврологические нарушения
. Цефалгический синдром — это головная боль, выраженная головная боль.
Также больших размеров образования, и чаще всего это именно неактивные аденомы, могут вызывать окклюзию желудочковой системы мозга
. Что это такое: у человека в голове есть специальная полость, желудочки мозга, в них вырабатывается ликвор — это такая прозрачная жидкость, вырабатывается там, всасывается она в позвоночном канале. При больших опухолях эти узлы могут перекрывать пути оттока жидкости. Жидкость вырабатывается, а оттекать ей некуда. Возникает такое состояние, называется гидроцефалия, или попросту водянка головного мозга. Что, конечно, требует какой-то срочной операции.
Гипопитуитарные нарушения
: вторичный гипокортицизм, вторичный гипотиреоз.
Также иногда бывает такое показание, как назальная ликворея
. Что это такое: назальное — это через нос, ликворея — это тот же самый ликвор, вот эта жидкость, которая стекает из носа. Большие опухоли с инфраселлярным ростом, я вам показывал ранее, которые растут в сторону вниз, в сторону полости носа, могут разрушать структуры основания черепа, которые я вам показывал (стенки, основные пазухи) и тогда эта жидкость может спокойно вытекать из носа. Что чревато тем, что микробы через полость носа (а это не самое чистое место все-таки у человека) могут попадать в полость черепа и вызывать, соответственно, такую симптоматику, как воспаление. Например, менингит — воспаление оболочек мозга, что чревато всякими опасными осложнениями.
Абсолютное показание к операции — это:
- снижение остроты зрения и сужение полей зрения,
- нарушение функции глазодвигательных нервов,
- нарушение оттока ликвора, гидроцефалия, о чем я сказал ранее,
- назальная ликворея,
- продолженный рост опухоли, несмотря на консервативное лечение — иногда такое, к сожалению, бывает — или, как я уже говорил, в некоторых случаях растёт пролактинома, хотя это не так часто,
- питуитарная апоплексия. Что это такое? Иногда бывает, особенно к этому склонны именно пролактиномы, к сожалению, в толще опухоли происходит кровоизлияние, и опухоль может резко увеличиться в размерах. При этом человек может резко вдруг потерять зрение. Это тоже может являться каким-то показанием к каким-то неотложным хирургическим мероприятиям.
Доступы существуют разные.
В основном мы делим их на транскраниальные, то есть через череп, через трепанацию черепа — через лобную кость, через височную кость. И трансназальные.
Рис. 11 Трансназальный доступ (угол хирургического действия)
В мире сейчас оперируют трансназальными доступами где-то процентов 90 опухолей
, поэтому будем говорить только про это.
Транскраниальные доступы нужны только в отдельно взятых случаях и это обсуждается отдельно с пациентами.
Как я уже говорил, доступ осуществляется через полость носа. Это основная пазуха, воздухоносоная, основная кость, в которой находится вот такая полость. Осуществляется трепанация передней стенки пазухи и задней стенки пазухи. И мы попадаем вот в этот костный кармашек, который называется турецкое седло, где лежит гипофиз, из которого могут развиваться большие опухоли. Стрелками показано, что даже через полость носа можно убирать большие опухоли, которые могут далеко выходить за полость турецкого седла. Это угол хирургического действия, который позволяет нам широко удалять большие опухоли с различными вариантами роста.
Очень много говорить, конечно же, про хирургическую технику
, я думаю, не стоит, но основное выделю.
То есть существуют некоторые методики, которые позволяют нам удалять распространенные сложные опухоли, большие, например, или те, которые имеют какой-то интересный рост в сторону: вправо, влево, вверх, вниз, которые не видны обычным взглядом, например, через микроскоп.
Для этого существует эндоскопическая техника
. Самое главное — это возможность заглянуть за угол. Не так часто опухоль находится строго посередине. Чаще всего они все-таки отклонены от средней линии и эндоскоп позволяет нам удалить их из-за угла. Хирург менее травматично удаляет эти опухоли у пациента, более безопасно для пациента.
Рис. 11. Применение эндоскопической техники
Также существует система, которая называется операционная нейронавигация
. Суть этой системы в том, что до операции пациенту делают снимки МРТ, загружают его снимки в компьютер, и во время операции хирург практически в реальном времени может оценить как проходит удаление опухоли, какие структуры встречаются, чтобы это было более безопасно для пациента.
В данном случае, если вы видите, то зелененькое сверху — это хиазма, то есть зрительные нервы, а красненькое — это сонные артерии. И на нижнем снимке видно, как хирург удаляет часть опухоли. И видно, что это происходит около сонной артерии и он тут должен быть внимательным, собранным, чтобы не повредить данный сосуд. И также это позволяет увидеть часть инструментов, которые могут быть зарегистрированы этой операционной системой, нейронавигацией. Хирург знает, где они расположены. Это очень важный момент.
12 и 13 Использование операционной нейронавигации
Рис. 14. Использование операционной нейронавигации
Применение нейроэндоскопии, системы операционной нейронавигации позволяют:
— Свободно ориентироваться в условиях узкой и глубокой операционной раны (мы говорим про трансназальную хирургию).
— Позволяет оперировать сложные и большие опухоли, я имею в виду крупные опухоли, которые раньше мы могли оперировать только транскраниальным доступом, теперь, при помощи этих систем, всё это можно оперировать спокойно через нос, в том числе опухоли со сложными вариантами роста, которые растут в разные стороны. Теперь при помощи эндоскопа и навигации их можно так же удалять.
— Хирургия при этом становится более безопасной для пациента и удобной для хирурга, уменьшается операционная травма для пациента.
— Также, как я вам уже говорил, образуется костный дефект в стенках основной пазухи. Эти системы позволяют его четко визуализировать и закрыть в конце операции. Это крайне необходимо, чтобы не было вот этой назальной ликвореи, о которой я вам говорил раньше, потому что это может приводить ко всевозможным осложнениям.
— Эта система, все вместе — позволяет улучшить общее состояние пациента после операции и как можно быстрее пациент возвращается к обычной жизни и быстрее выписывается из стационара. Что, мне кажется, является очень важным для пациента.
Некоторые клинические случаи
я вам покажу.
- Вот, например, (Рисунок 15) в красном кружочке — это гигантская аденома гипофиза
. В данном случае это была пролактинома с супраселлярным ростом кверху и с инфраселлярным ростом книзу. Верхние — это до операции, нижние — это после операции. Но, как видите, опухоль удалена полностью. Пациентка наблюдается уже несколько лет и все хорошо. Операция выполнена в одну сессию, через нос.
Рис. 15 Клинический случай, гигантская аденома гипофиза
- То же самое. Пациентка, которую я оперировал, она приехала из Узбекистана. (Рисунок 16) Пациентка, у которой случилась питуитарная апоплексия
. Резко пациентка ослепла, практически ослепла, было только светоощущение. Вот это до операции, и в послеоперационном периоде. Опухоли нет. К пациентке зрение вернулось. Такие чудеса тоже случаются. Питуитарная апоплексия — это вот. То есть гематома находится в толще опухоли, расширяет капсулу опухоли. Опухоль становится значительно большего размера.
Рис. 16 Клинический случай, питуитарная апоплексия
- Также покажу небольшие образования
(рисунок 17). Они не менее важны. Это гормонально активная соматотропинома, то есть опухоль, выделяющая гормон роста. Не знаю, видите ли вы или нет, вот это вот опухоль, а гипофиз — вот тут небольшая беленькая часть, кусочек остался. Эта опухоль имеет рост в сторону, черные точки — это сонные артерии. Она как бы обрастает сонную артерию. И снимки после операции. То есть это рост латероселлярный (вправо или влево). И удалось удалить, в том числе вокруг сонной артерии. Все благополучно, пациент живет спокойно дальше.
Рис. 17. Клинический случай, небольшие образования
- Также не менее актуальной является хирургия микроаденом гипофиза
(рисунок 18). Для чего, кстати, очень важна система нейронавигации, которая позволяет точно визуализировать, где находится опухоль. Стрелкой показано, вот эта вот точечка. Это микроаденома, которая находится в толще нормального гипофиза. А снизу — как она удалена. Гипофиз сохранился, человек выздоровел, живет хорошо дальше. Это была кортикотропинома.
Рис. 18 Клинический случай, микроаденома (кортикотропинома)
Среднее пребывание в палате реанимации у пациентов в основном не более суток.
Пациент прооперирован, на следующий день переводится в свою палату. На 3-6 сутки он может быть выписан.
Фотография сделана на третьи сутки после операции. Это типичные пациенты с акромегалией, у которых были удалены опухоли, выделяющие гормон роста, соматотропиномы.
Послеоперационный период — в среднем это 3-5 суток в стационаре
. Конечно же, это зависит от множества различных факторов.
Производится в это время:
- санация носовой полости, при необходимости консультация лор-врача.
- консультация эндокринолога, гормональный профиль после операции, через 2-3 месяца, через полгода и через год.
- МРТ головного мозга с контрастным усилением через 3-6 месяцев,
- консультация нейрохирурга.
У многих пациентов возникает вопрос, по крайней мере, ко мне так пациенты обращались. Вот посмотрите, гигантская аденома до операции, после операции, непосредственно снимок сделан на вторые сутки, и через год. На вторые сутки после операции тут стоит вопросик. Что это значит. Если посмотреть, врачи-рентгенологи могут описать этот снимок как неудаленная опухоль или неполностью удаленная опухоль (Рисунок 19)
. И у пациента, и у хирурга сразу возникает вопрос, так ли это на самом деле. Посмотрите, что через год. Через год никакой опухоли нет. Более того, то, что образовался синдром пустого седла, это бывает. В данном случае, он не привел ни к каким патологическим результатам. Что это значит? Дело в том, что метод МРТ — это самый лучший метод для определения опухоли гипофиза.
Но в послеоперационном периоде, когда в ране операционной возникает отек, когда хирург во время операции ставит внутрь раны специальный материал, называется гемостатический материал, чтобы остановить кровотечение внутри, и чтобы заклеить вот эти дефекты костные. Этот материал набухает от крови, от ликвора и в послеоперационном периоде может выглядеть на снимке так (как неудаленная опухоль)
. Необходимо, чтобы пациенты это знали и не волновались. То есть это момент, на мой взгляд очень важный. Поэтому есть стандарт, который принят во всем мире, это делается минимум через месяц, полтора-два после операции.
Рис. 19 Снимки МРТ до операции, сразу после и через год
Также применительно к гормонально активным опухолям. Я беру пациентку с соматотропиномой, это было апрель 2007 года. Пациентка сама мне прислала вот такой вот интересный график (Рисунок 20), где она показала, как у нее снижался гормон роста СТГ и ИфР-1. Гормон роста упал практически сразу. А ИФР не падал очень-очень долго
. И в конечном итоге нормализовался, получается, сентябрь 2010 года. Пациентке при этом постоянно выполнялись МРТ головного мозга с контрастом. Опухоли не было. Но ИФР не падал. Пациентка продолжала лечиться соответствующими препаратами, о которых вам уже говорили. И в 2010 году она была снята с терапии, сейчас наблюдается. И нормальные показатели ИФР и СТГ, и при МРТ ничего нет. Это говорит о том, что
биохимические показатели не всегда могут сразу снижаться,
это тоже имеет значение для пациентов.
Рис. 20 Динамика СТГ, ИРФ-1 после операции
Хотелось бы такой промежуточный вывод: что для успешной операции
необходим достаточный опыт хирурга
. Сейчас считается в мире, что у хирурга, который оперирует эти опухоли трансназальным доступом, должен быть опыт примерно 200-300 пациентов. И приблизительно от 30 до 50 пациентов в год. Тогда считается, что у пациентов бывает наименьшее количество осложнений и наиболее радикальное удаление с наименьшим процентом каких-то неблагополучных результатов.
Также я считаю, что необходим хороший контакт пациента с хирургом
, это крайне важно, потому что пациент должен понимать, для чего он все это делает, как ему вести себя в послеоперационном периоде, что у него будет выполнено во время операции. Считаю, что это очень важный момент.
Нужна отличная диагностика
, МРТ. Иногда, как я уже говорил ранее, для визуализации костных структур, это КТ. Иногда, в некоторых случаях, когда МРТ сделать нельзя, оперируют по КТ. Например: у пациента стоит кардиостимулятор. МРТ выполнить невозможно. Тогда приходится оперировать по КТ.
Конечно же, это командная работа
: то есть это офтальмолог, невролог, эндокринолог, нейрохирург, рентгенолог, лор-врач, иногда радиотерапевт, если будет требоваться лучевая терапия.
Конечно, то, что я говорил ранее. Современная хирургическая техника
, инструменты, специальные гемостатические материалы.
В некоторых случаях мы пациентов облучаем
, это бывает на самом деле не так часто, потому что считается, что при облучении может пострадать гипофиз. А нам совсем не нужно, чтобы у пациента возникали нарушения — называются гипопитуитарные нарушения, то есть нарушения работы, нормальной функции гипофиза.
Опасность и прогнозы
При аденоме гипофиза прогноз зависит от размера опухоли, возможности радикального удаления и ее гормональной активности. При своевременной диагностике и адекватном лечении заболевания выздоровление наступает более чем у 85 % пациентов. Если продолжительность болезни небольшая, вероятность полного восстановления зрительной функции довольно высока.
При кровоизлиянии в опухоль лишь немедленное вмешательство хирурга может спасти ситуацию. Чем быстрее пациент обратится в Юсуповскую больницу и получить специализированную медицинскую помощь, тем больше вероятность удачного излечения.
Обсуждение
Применение эндоскопической техники в транссфеноидальной хирургии обеспечивает панорамный обзор операционного поля в условиях хорошей освещенности, а эндоскопический эндоназальный транссфеноидальный доступ является малотравматичным и по сравнению с другими типами операций позволяет не только повысить радикальность хирургического лечения, но и уменьшить количество послеоперационных осложнений и сроки реабилитации больных в послеоперационном периоде [14-16, 18, 19].
Для удаления АГ с латероселлярным ростом возможно использование как стандартного эндоскопического эндоназального транссфеноидального, так и латерального расширенного транссфеноидального доступов. Стандартный ЭЭТД позволяет выполнять удаление АГ из полости КС через дефект в его медиальной стенке. Расширение области костной резекции латерально за пределы дна турецкого седла — осуществление ЛРТЭД, обеспечивает доступ к области КС латеральнее ВСА, позволяет выполнить резекцию опухоли из самых латеральных и передненижних отделов синуса.
Врастание опухоли в полость КС снижает частоту тотально выполненных операций и увеличивает количество послеоперационных осложнений. По данным П.Л. Калинина [16], количество тотальных резекций АГ при их врастании в полость КС заметно ниже (51%), чем при отсутствии латероселлярного распространения опухоли (86,9%).
На количество тотального удаления АГ также влияет степень инвазии опухоли в полость КС (согласно Knosp Scale). G. Woodworth и соавт. [21] отмечают наличие статистически достоверной (p
=0,04) разницы между количеством тотального удаления АГ со степенью инвазии Grade I и Grade II по сравнению с резекцией опухолей со степенью Grade III и Grade IV (84,6 и 66,6% соответственно).
В нашем исследовании частота тотально удаленных АГ составила 50,51% (n
=49). При этом статистически достоверно реже (
p
<0,05) удавалось выполнить тотальное удаление опухоли с массивной инвазией в полость КС — Grade III и Grade IV.
B. Zhao и соавт. [22] в своей работе, посвященной оценке результатов хирургического лечения АГ, обращают внимание, что степень тотального удаления плотных опухолей ниже, чем мягких (50 и 64,1% соответственно). В проведенном нами исследовании статистически достоверно реже удавалось выполнить тотальное удаление плотных аденом по сравнению с мягкими (p
<0,05).
Однако стоит обратить внимание на то, что независимо от плотности опухоли и ее гормональной активности, попыток удаления из полости КС не предпринималось при наличии единственного хорошо видящего глаза на стороне инвазии (4 наблюдения). Выполнялась заведомо нерадикальная операция с целью максимально снизить риск повреждения n
.
oculomotorius
. Его повреждение могло бы привести к опущению верхнего века на стороне глаза с хорошей остротой зрения.
Увеличение степени инвазии гормонально-активных АГ в полость КС статистически достоверно снижает частоту развития гормональной ремиссии заболевания (p
<0,05).
В работе H. Nishioka и соавт. [23] гормональная ремиссия заболевания наблюдалась в 90% случаев при степени инвазии Grade I и Grade II, в 68,2% наблюдений при Grade III, и не было ни в одном случае со степенью инвазии Grade IV.
При помощи 30°, 45°, 70° эндоскопов удаление АГ проводилось «из-за угла» под непосредственным визуальным контролем и в условиях хорошей освещенности операционной раны, что объясняет более высокую частоту тотальных резекций опухолей в исследуемой группе по сравнению с группой пациентов, оперированных с использованием микрохирургических методик. Экстрадуральный доступ, также как и эндоскопический, позволяет удалять опухоли из полости КС под непосредственным визуальным контролем, что объясняет отсутствие статистически достоверных различий в степени радикальности при использовании данных методик.
Динамика зрительных функций — один из основных показателей безопасности и эффективности хирургического лечения пациентов с А.Г. По данным П.Л. Калинина [16], использование методики эндоскопической транссфеноидальной аденомэктомии позволяет добиться улучшения зрительных функций в таком же количестве случаев, как и после использования стандартных микроскопических методик. Однако использование эндоскопической техники позволяет снизить количество случаев ухудшения зрительных функций, по сравнению с результатами традиционных микроскопических транссфеноидальных операций.
В нашем исследовании частота улучшения зрения была выше по сравнению с результатами, полученными в группе сравнения (см. табл. 1). Однако выявить статистически достоверные различия не удалось.
Частота глазодвигательных нарушений при осуществлении резекции опухоли из полости КС составила 14,4% случаев (n
=14). Развившиеся после операции глазодвигательные нарушения чаще всего являлись функциональными и регрессировали в течение нескольких месяцев после операции.
В целом по частоте послеоперационных глазодвигательных нарушений наша работа значительно не отличалась от ранее проведенных исследований. Например, M. Kitano и соавт. [5] сообщают о повреждении глазодвигательных нервов в 27% случаев после удаления опухолей из латерального расширенного транссфеноидального доступа.
Нарушение функций глазодвигательных нервов статистически достоверно чаще наблюдалось при массивной степени инвазии АГ (Grade III и Grade IV) по сравнению с незначительной (Grade I и Grade II) степенью инвазии (p
<0,05). В исследовании W. Couldwell и соавт. [12] повреждения черепно-мозговых нервов при транссфеноидальных операциях наблюдались в 4% случаев, исключительно после резекции опухоли из полости КС.
Частота появления/нарастания глазодвигательных расстройств после эндоскопических транссфеноидальных операций практически не отличается от частоты развития глазодвигательных нарушений после микроскопической транссфеноидальной резекции опухоли. И это несмотря на возможность осуществления гораздо более активных эндоскопических хирургических манипуляций в полости КС для более полного удаления опухоли.
Эндоскопическое удаление при использовании ЛРТЭД проводится через передненижнюю стенку КС, где отсутствуют какие-либо черепно-мозговые нервы, в то время как при экстрадуральном доступе манипуляции в полости КС осуществляются через его латеральную стенку, где располагаются черепно-мозговые нервы, что чревато их повреждением. Поэтому появление глазодвигательных нарушений после эндоскопических операций с использованием ЛРТЭД наблюдалось по сравнению с экстраинтрадуральным доступом статистически достоверно реже (p
<0,05).
По данным проведенного топографоанатомического исследования, повышение риска повреждения VI черепно-мозгового нерва может наблюдаться при удалении опухоли из задненижних и передненижних отделов синуса, латеральнее кавернозного сегмента ВСА, а повреждение III черепно-мозгового нерва — из задневерхних и передневерхних отделов, также латеральнее внутренней сонной артерии (рис. 6).
Рис. 6. Анатомический препарат (45° эндоскоп). Представлен левый кавернозный синус. Паракливальный сегмент внутренней сонной артерии смещен шпателем латерально. Виден выход VI черепно-мозгового нерва из канала Дорелло в полость кавернозного синуса (указан стрелкой). Зеленой линией выделены нижнезадние и передненижние области кавернозного синуса. Красной линией выделены задневерхние и передневерхние отделы кавернозного синуса, где проходит III черепно-мозговой нерв; 1 — ганглий тройничного нерва; 2 — симпатические нервы, идущие вдоль ВСА, которые указывают на местоположение VI черепно-мозгового нерва; Г — гипофиз; С — скат; III — n. oculomotorius, VI — n. abducens, V2 — вторая ветвь тройничного нерва; пунктирной линией выделена верхняя глазничная щель. (Препарат выполнен О. Шариповым, П. Калининым, М. Кутиным под рук. Г. Ф. Добровольского).
Выраженные неврологические нарушения в виде полушарной и/или психопатологической симптоматики в нашем исследовании отсутствовали, что может быть объяснено возможностью более радикального удаления опухолей с использованием эндоскопической техники и проведением манипуляций в условиях хорошей видимости, а также отсутствием тракции мозгового вещества.
Структура осложнений после эндоскопических транссфеноидальных операций в целом такая же, как и после стандартных микроскопических транссфеноидальных операций.
Безопасность использования транссфеноидальных методик, как микрохирургических, так и эндоскопических, нашла подтверждение и в других работах. В исследовании П.Л. Калинина [16] тяжелые неврологические нарушения наблюдались 1,2% случаев, а по данным А.Ю. Григорьева [24], гемисиндром и/или психические нарушения после транссфеноидального микрохирургического удаления опухоли были отмечены у 2,9% пациентов.
В группе больных, где опухоль удалялась из экстраинтрадурального доступа, тяжелые неврологические нарушения выявлены в 14,3% случаев, и по сравнению с группой пациентов, оперированных с помощью ЛРТЭД, частота полушарной и/или психопатологической симптоматики наблюдалась статистически достоверно чаще (p
=0,02).
Одной из актуальных проблем транссфеноидальной хирургии, особенно в случаях использования расширенных транссфеноидальных доступов, является надежная пластика послеоперационных дефектов, так как отсутствие адекватно выполненной пластики дефекта основания черепа приводит к развитию потенциально опасного осложнения — назальной ликвореи.
Например, в исследовании B. Zhao и соавт. ликворея наблюдалась в 5,6% случаев.
В нашем исследовании случаев назальной ликвореи не было. Использование эндоскопической техники позволяет статистически достоверно снизить количество послеоперационных назальных ликворей после транссфеноидального удаления АГ по сравнению с результатами стандартных микроскопических операций (p
<0,05).
Повреждение ВСА — редкое, но потенциально смертельное осложнение, которое наблюдается в 0-3,8% случаев [25, 26].
Избежать повреждения ВСА в процессе эндоскопического транссфеноидального удаления опухоли позволило применение интраоперационной допплерографии. Необходимость использования данной методики при выполнении стандартных транссфеноидальных операций была связана, во-первых, с отсутствием анатомических ориентиров в полости клиновидной пазухи, которые необходимы для определения правильной траектории доступа (16 случаев), а во-вторых, при попытках удаления латероселлярно расположенной плотной опухоли для выявления объема ее безопасной резекции в синусе (7). При использовании латерального расширенного транссфеноидального эндоскопического доступа (26 случаев) описываемая методика позволила определить границы разреза ТМО и безопасно манипулировать в латероселлярном пространстве.
По данным А.Ю. Григорьева [24], летальность после транссфеноидальных аденомэктомий составила 1,9%. В работе П.Л. Калинина после эндоскопического эндоназального транссфеноидального удаления АГ в стационаре скончались 7 пациентов из 434 (летальность 1,6%) [16].
В исследуемой группе не наблюдалось случаев летальных исходов и по сравнению с микрохирургическим транссфеноидальным удалением эндоскопическая методика статистически достоверно снижает частоту летальных сходов (p
<0,05).
Аденома гипофиза – лечение в Москве
Сколько стоит удаление аденомы гипофиза в Москве? Операцию удаления аденомы гипофиза по приемлемой цене выполняют в Юсуповской больницы. Хирурги в совершенстве владеют всеми методиками оперативных вмешательств на гипофизе. Стоимость трансназального удаления аденомы гипофиза в Москве от 14000 до 120000рублей.
В Юсуповской больницы врачи проведут комплексное обследование, установят точный диагноз, определят оптимальный метод лечения аденомы гипофиза. При наличии показаний и отсутствии противопоказаний выполняют операцию с использованием новейшей аппаратуры ведущих европейских и американских фирм. Стоимость операции удаления аденомы гипофиза узнавайте по телефону.