Статья на конкурс «био/мол/текст»: Прионные заболевания — феномен, открытый в двадцатом веке, и в нем же начавший играть большую роль: увеличение продолжительности жизни в развитых странах привело к тому, что все больше людей стало доживать до «своего Альцгеймера» или «своего Паркинсона». Природа нейродегенеративных заболеваний продолжает оставаться туманной, и ученые пока исследуют только отдельные их аспекты — например, причину развития именно в старческом возрасте или способность передаваться от одних видов живых существ другим.
«Био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Всё началось с того, что в 20 веке учёные заинтересовались природой необычных заболеваний человека и животных: куру, Крейтцфельда-Якоба, скрэпи. Заметное сходство патологии этих болезней дало основание для гипотезы об их инфекционности, что впоследствии было экспериментально подтверждено. Тогда возник вопрос о возбудителе данных заболеваний. Прежде чем был найден ответ, были выявлены необычайные свойства возбудителей: они не размножаются на искусственных питательных средах, устойчивы к высокой температуре, формальдегиду, различным видам излучений, действию нуклеаз. Очистка инфекционного материала и его изучение позволило провозгласить о том, что «во всём виноват» белок, который 30 лет назад получил название прион (от англ. prion — белковая инфекция).
Так, известные американские учёные — вирусолог и врач Д.К. Гайдушек, раскрывший инфекционную природу прионных болезней, в 1976 г. и биохимик С.Б. Прузинер, который определил прионы и разработал прионную теорию, в 1997 г., — были удостоены Нобелевских премий. Их работы стали импульсом для последующих исследований, благодаря которым были изучены новые виды прионных инфекций. Но, даже несмотря на неугасающий интерес к «прионной теме», образование прионов до сегодняшнего дня остаётся загадкой.
Прион — убийца нейрона
Прион, также известный в микробиологии как инфекционный PrPSc, – это профессиональный термин, описывающий дефектную форму протеина, часто встречающегося в тканях мозга млекопитающих, способствующего долгосрочному функционированию памяти.
Развитие прионной болезни в Википедии (Wikipedia, eng.) описывается так: «…Эти контагиозные молекулы ответственны за возникновение трансмиссивных спонгиоформных энцефалопатий или прионопатий. Их центральные проявления – мозжечковые расстройства и чрезвычайно быстрое слабоумие».
Прионы убивают нейроны очень быстро, что провоцирует стремительное развитие дегенеративных заболеваний.
Согласно теории, речь идет об источнике многих нарушений ЦНС животных (включая человека). Эти белки играют роль в наследственных изменениях и эволюции.
Один из регуляторных факторов прионопреобразования – шапероны, функция которых заключается в чистке клеток от патогенных белков. Как шапероны, так и прионы относятся к группе клеточных протеинов.
Теории и гипотезы
С. Б. Прусинер
Теория, объясняющая, почему прионы убивают нейроны, была сформулирована профессором С. Б. Прусинером в 1982 г. Он также впервые использовал слово «прион» (первоначально предназначалось использование обозначения «проин», как сочетания слов «proteinaceous» и «infectious», но в измененном состоянии оно звучало лучше).
Теорию прионов, как патогенных белков, Прусинер сформулировал в связи с поиском возбудителя расстройства Крейтцфельда-Якоба. Обнаруженный ним агент являлся чем-то новым. До 1982 г. считалось, что инфекционные заболевания могут вызывать только инфекционные организмы, содержащие нуклеиновую кислоту, несущую генетическую информацию. Но строение белка не содержит нуклеиновой кислоты. Это белок, размножающийся, изменяя аналогичные белки в организме. В 1997 г. С. Б. Прусинер получил Нобелевскую премию в этой области.
Патогенные белки прионы имеют одинаковую первичную структуру (аминокислотную последовательность), но различаются по своей конформационной конфигурации. В то время как дикий PrPс имеет выраженное преобладание α-геликса и около 5% β-листа, патогенный PrPSc (Sc – scrapie) имеет долю β-листа до 40%. Причины аберрантных свойств прионов PrPSc все еще рассматриваются. Сегодня есть несколько гипотез.
- Вирусная гипотеза объясняет воздействие прионов вирусологией. Предполагается участие РНК-вирусов в трансмиссивных губчатых энцефалопатиях. Как вироиды, так и прионы – мелкие инфекционные патогены; следовательно, результат воздействия вируса – прион инфекционной природы.
- Мультикомпонентная гипотеза. Предполагается, что для образования инфекционных белков, как новых возбудителей болезней необходима связь с полианионами и липидами.
- Отравление тяжелыми металлами. Интоксикация вызывает развитие инфекции при недостатке или избытке в организме меди (для здорового протеина необходимо оптимальное количество меди).
В чем заключается токсичность белка для нейрона?
После появления инфекционного протеина он может «запечатлеть» свою конформацию в здоровые нейроны. Токсические протеины могут убивать митохондрии в нейронах, распространяя болезнь на ткани.
Патогенные белки чрезвычайно устойчивы к физическим и химическим воздействиям, что приводит к трудностям при стерилизации (были предприняты попытки сжигания головного мозга у пораженных животных при 600°C, пеплом впоследствии были заражены примерно 1/3 животных). В соответствии с тем, какие метаболические процессы нарушают прионы в нейроне, наиболее инфекционные – ткани глаза, головного и спинного мозга.
Статья в тему: Признаки болезни Альцгеймера
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
Молекула приона не является чем-то экзотическим: в «нормальной» форме она имеется на поверхности нервных у каждого из нас. При этом мы отлично себя чувствуем, и наши нервные клетки живы и здоровы. Однако это всё до тех пор, пока наш нормальный белок не «переродится» в аномальную форму. А если это случится, то приведёт к ужасающим последствиям: инфекционная форма прионов имеет свойство «склеиваться» с другими молекулами и, мало того, «конвертировать» их в эту же самую форму, вызывая «молекулярную эпидемию». В результате этой полимеризации на нервной клетке появляются токсичные белковые бляшки , и она погибает [1]. На месте погибшей клетки образуется пустота — вакуоль, заполненная жидкостью. С течением времени будет исчезать один нейрон за другим, а в мозге — образовываться всё больше «дыр», пока, наконец, мозг не превратится в губку (рис. 1), за чем неминуемо последует смерть.
Существует упрощенное представление, что полимеризованные прионные фибриллы «протыкают» нейрон, что вызывает его гибель. На самом деле это не совсем так: предшествующие фибриллярной стадии сферические агрегаты прионов также обладают токсичностью (по крайней мере, для болезни Альцгеймера): «Альцгеймеровский нейротоксин: ядовиты не только фибриллы». — Ред.
Но как может нормальный природный белок (обозначается PrPC) вдруг стать патологическим (PrPSc; Sc — от слова «scrapie»)? Что должно произойти? Как и в случае «обычной» инфекции, для такой трансформации необходима встреча с молекулой инфекционного приона. Существуют два пути передачи этой молекулы: наследственный (за счёт мутаций в гене, кодирующего белок) и инфекционный. То есть внедрение приона может произойти неожиданно — например, при употреблении в пищу недостаточно хорошо прожаренного или сваренного мяса (в котором должна присутствовать форма PrPSc), при переливании крови, при трансплантации органов и тканей, при введении гормонов гипофиза животного происхождения.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Заразные прионы оказались нетоксичными для нервных клеток
Очищенные инфекционные прионные белки, собранные в палочковидные структуры
Cassandra Terry
Прионы-передатчики нейродегенеративных заболеваний, и прионы, которые повреждают нейроны, — это разные молекулы, сообщается в Proceedings of the National Academy of Sciences
. Это выяснилось в ходе экспериментов, в которых к питательной среде культур нервных клеток добавляли либо экстракт очищенных прионов (переносчики инфекций), либо гомогенизированную ткань мозга животных, демонстрировавших симптомы прионных заболеваний, в том числе нейродегенерацию. В первом случае клетки в культурах оставались нетронутыми, во втором повреждались.
Прионы — это белковые инфекционные агенты, а от прочих протеинов они отличаются способностью принимать очень устойчивые конформации и «заражать» ими соседние молекулы такого же состава. В результате белки особой, патологической конформации образуют скопления и деформируют клетки, в которых находятся. Особенно часто это происходит в нервных клетках, и многие прионные болезни поражают мозг. Повреждения получаются очень сильными и необратимыми, и больной, как правило, погибает. Лечения прионных заболеваний пока не существует.
Прионные заболевания могут быть наследственными, если имеются мутации в генах соответствующих белков. Кроме того, ими можно заразиться, если съесть мозг или мясо инфицированных особей (термическая обработка и многие пищеварительные ферменты, как правило, не разрушают прионные скопления) или вступить в контакт с жидкостями их тела. Однако на молекулярном уровне детали заражения прионными инфекциями еще неясны.
Исследователи из Университетского колледжа в Лондоне во главе с Джоном Коллинджем (John Collinge) проверили, как действуют на первичные культуры нейронов (то есть «готовые» нервные клетки, изъятые непосредственно из организма животного) новой коры больших полушарий и гиппокампа мышей различные прионы.
К питательной среде, в которой находились одни культуры, исследователи на 72 часа добавляли в разных концентрациях очищенные палочковидные скопления молекул прионного белка, кодируемого геном Prnp
, выделенные из мозга мышей с симптомами прионного нейродегенеративного заболевания (от 107,7 до 108,1инфекционных единиц на миллилитр). В других случаях вместо очищенных белков использовали гомогенизированную ткань мозга больных мышей, в ней содержалось от 104,2 до 105,7 инфекционных единиц прионов на миллилитр. Наконец, в часть культур ввели гомогенаты мозга здоровых животных, куда предварительно добавили очищенные «заразные» прионные белки. Для контроля использовали белки со «здоровой» конформацией, не способные инфицировать клетки.
За состоянием нейронов в культуре — количеством, длиной и степенью ветвления их отростков, а также тем, живы ли они, наблюдали с помощью флуоресцентной микроскопии: подбирали к молекулам, характерным для разных регионов и функциональных состояний нервной клетки, антитела, связанные с флуоресцентными белками, дающими свечение разных цветов, и смотрели, где и с какой интенсивностью оно проявится.
Состояние нейронов в культуре в различные дни после добавления очищенных прионов или гомогенизатов мозга больных животных. На графиках указаны длины отростков в зависимости от того, чем и в какой концентрации обрабатывали культуры.
Iryna Benilova et al. / Proceedings of the National Academy of Sciences, 2020
Поделиться
Длина отростков нервных клеток и количество выростов на них уменьшались только в одном случае — когда к культуральной среде добавляли гомогенат мозга мышей с прионным заболеванием. Очищенный прион из тканей больных животных, в том числе в составе гомогената мозга здоровых грызунов, не вредил нейронам, как и очищенный «безопасно сложенный» прионный белок из них. Нейротоксический эффект гомогенизированного мозга больных мышей исчезал под действием двухпроцентного натрий лауроилсаркозина — вещества, которым в ряде случаев обрабатывали гомогенаты. При этом количество молекул инфицирующего приона не снижалось.
Из этих данных исследователи сделали вывод, что у прионов функция заражения клеток и токсическое действие на эти клетки не связаны жестко друг с другом. Вероятно, они обеспечиваются различными типами молекул и (или) формами их скоплений. Видимо, прионы, образующие палочковидные скопления, нетоксичны для нейронов, а белки в составе скоплений какой-то другой формы, напротив, им вредят. Известно, что плохо очищенные прионы повреждают нервные клетки, но в предыдущих исследованиях не уточнялось, какой формы должны быть их группы, чтобы быть токсичными. Это и непросто установить: в таких смесях встречаются прионные скопления самых разных форм и размеров. Новые исследования должны быть направлены на то, чтобы все-таки это проверить.
Не вызывающие заболеваний прионы уже находили. В 2021 году итальянские ученые выделили из мозга овец, больных почесухой (скрейпи), молекулы PrPSc, размножили их, «адаптировали» под строение прионов у восприимчивых к скрейпи рыжих полевок (Myodes glareolus
) и попробовали этими веществами инфицировать грызунов. Одна из разновидностей PrPSc овец по какой-то причине не могла спровоцировать у полевок почесуху — вероятно, из-за особенностей структуры молекулы.
Светлана Ястребова
Некоторые сведения о прионах
Исследователи отмечают:
- прионный белок включает 254 аминокислотных остатка и «весит» 33–35 килодальтон [2];
- ген, кодирующий белок PrP, найден у человека, млекопитающих и птиц [1];
- для полного уничтожения прионного белка нужна температура не менее 1000 градусов [1]!
- возможно, прионы принимают участие в межклеточном узнавании и клеточной активации [3];
- не исключено, что функцией прионов является подавление возрастных процессов [3];
- при развитии клинических проявлений прионных заболеваний нет ни признаков воспаления, ни изменений в крови;
- предполагается, что прионы участвуют в развитии шизофрении и миопатии;
- механизм действия прионов и их превращения из нормальной формы в патологическую остаётся неясным.
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
Знаменитый исследователь прионов Стэнли Прузинер (Stanley Prusiner) выделяет две поразительные особенности, присущие таким нейродегенеративным заболеваниям, как болезнь Крейтцфельда-Якоба, болезнь Альцгеймера и болезнь Паркинсона. Первая заключается в том, что более 80% случаев заболевания — спорадические (то есть, случайные, возникающие «сами собой»). Вторая: несмотря на то, что большое количество мутантных белков, специфичных к определённой болезни, экспрессируется в процессе зародышевого развития, формы наследования этих нейродегенеративных заболеваний проявляются позже. Это предполагает, что некоторые процессы происходят во время старения, которое «дает волю» болезнетворным белкам [5]. Более 20 лет назад автор утверждал, что данный процесс включает случайный рефолдинг (пересворачивание) белка в неправильно свёрнутый, что соответствует переходу в инфекционное состояние — прион.
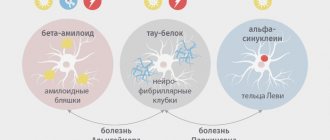
Интересные факты насчет болезни Альцгеймера: ее вероятность может повышаться вследствие хронического недосыпания («Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска»), а сам альцгеймеровский нейропептид (β-амилоид Aβ) может быть частью системы врожденного иммунитета («Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета»). — Ред.
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].
Рисунок 2. Процессы нейродегенерации, вызванной прионами. Сверху: накопление «нормального» прионного белка повышает его вероятность перехода в токсичную конформацию, которая описывается бóльшим содержанием β-структуры. Прионы наиболее патогенны в форме олигомеров; после образования фибрилл токсичность снижается. В зависимости от того, о каком конкретно прионном белке идет речь, в патологическом состоянии он может образовывать бляшки, клубки или тельца включения. Возможные пути лекарственного вмешательства: (I) снижение кон белка-предшественника; (II) ингибирование образования прионной формы; (III) уничтожение токсичных агрегатов. Снизу: Наследственная старческая нейродегенерация объясняется двумя событиями: наличием мутантной формы предшественника и образованием из него приона, готового к олиго- и полимеризации с образованием токсичных форм.
[5]
Прионные заболевания человека: симптоматика и перспективы лечения
Механизмы человеческих заболеваний, вызываемых прионами (англ. от Protein («белок») и Infection («Инфекция»); впервые слово было использовано С. Прузинером [1] в конце XX века), до сих пор остаются малоизученными, несмотря на, казалось бы, большой объём исследований, проводимых в данной сфере. Цель настоящей статьи заключается в обобщении и понятном объяснении имеющейся на данной момент информации, касающейся прионов и ассоциированных с ними болезней.
В рамках настоящей статьи приняты следующие сокращения: prion — proteinacious infectious particle; PrP — прионный белок; PrPC — нормальная изоформа прионного белка; PrPSc — инфекционная форма прионного белка; PRNP — ген, кодирующий прионный белок.
Прионные заболевания (также известны как трансмиссивные губчатые энцефалопатии, ТГЭ), ставшие известными человеку в середине XVIII века, являются одним из наиболее интригующих биологических феноменов. Исследования этого явления начались в XX веке с попыток определить биологическую сущность возбудителей сразу нескольких специфичных болезней животных и человека со схожей симптоматикой. Гипотеза об их общей этиологии, выдвинутая в 1960-х годах учёными радиобиологом Т. Альпером и математиком Д. Гриффитом [2] и позже дополненная и доказанная врачом С. Прузинером [3], дала толчок последующим исследованиям в этой области. Однако, несмотря на глубокую заинтересованность научного мира, многие аспекты существования прионов остаются неизученными и по сей день.
К числу человеческих болезней, связанных с этими особыми белковыми инфекционными агентами, относятся болезнь Якоба-Крейтцфельда (CJD) и её различные вариации, фатальная бессоница (FFI/FSI), болезнь Герстмана-Шраусслера-Шейнкера (GSS), куру, вариабельная протеаза-чувствительная прионопатия, и прионное заболевание, связанное с диареей и поражением вегетативной нервной системы.
Все вышеперечисленные прионные болезни на сегодняшний день остаются смертельными, что помещает их в категорию наиболее опасных болезней.
Сущность прионов
После окончания процесса перевода генетической информации, заключённой в виде нуклеотидной последовательности РНК (рибонуклеиновой кислоты), в специфическую последовательность аминокислот, формирующую первичную структуру всех протеинов, новосинтезированные белки сворачиваются в определённые структуры. Прионы — разновидность белковых молекул с неправильной «укладкой» (Рис. 1), дефектная форма нормального мембранного белка PrP, который экспрессируется (проявляется) преимущественно в клетках центральной нервной системы.
Рис. 1. Правильно «сложенный» (слева) и дефектный (справа) белки [4]
Благодаря определённым биологическим машинериям, обычные неправильно сложенные белки легко утилизируются и не оказывают отрицательного эффекта на процессы человеческой жизнедеятельности. Прионы отличаются устойчивостью к этим механизмам и наличием способности превращать нормальные составляющие их белки в себе подобные. Существует две гипотезы, описывающие механизмы этого явления. Согласно первой, гетеродимерной модели (Рис. 2) [5], превращение происходит следующим образом: PrPSc присоединяется к «здоровой» молекуле PrP, и катализирует ряд конформационных изменений, приводящих к её переходу в прионную форму, после чего уже два ненормальных белка расходятся и запускают новые раунды этого процесса. При этом наличие агрегированной («склеенной») формы белка не является обязательной частью прионной трансформации.
Рис. 2. Гетеродимерная модель прионной репликации [6]
Альтернативная гипотеза (Рис. 3) [5] — полимеризационная — гласит, что катализ конформационного превращения нормального белка в патологический может происходить только при «нуклеализации» с последующим образование олигомерных или мультимерных комплексов. Стоит отметить, что последние исследования говорят в пользу второй модели.
Рис. 3. Цикл репликации PrPSc в соответствии с полимеризационной гипотезой [7]
Воздействие PrPSc приводит к этакой «внутриклеточной эпидемии»: образуется множество нефункциональных белковых бляшек на клетках организма, из-за чего он рано или поздно погибает.
Пути возникновения прионных заболеваний
Считается, что существует всего три пути приобретения прионных заболеваний: прямое инфицирование, наследственная передача и спорадическое возникновение по неизвестному механизму [8], но вне зависимости от происхождения они могут быть переданы инфекционным путём.
Был детектирован высоконсервативный ген PRNP, несущий информацию о нормальной изоформе белка PrP, находящийся в p-плече 20-ой хромосомы человека [9]. PRNP имеет протяженность 16 тысяч нуклеотидных последовательностей и содержит 2 экзона. Все наследственные прионные заболевания связаны с аутосомным наследованием мутаций, произошедших в данном гене.
Рис. 4. Локализация гена PRNP в 20-ой хромосоме человека [10].
Основной способ возникновения прионной болезни — спонтанный. Согласно одной из гипотез, объясняющих этот процесс, в нормальных белках происходит определённая посстрансляционная модификация [11]. Иная гипотеза постулирует, что в какой-то конкретный момент неопределённое количество клеток организма соматически (ненаследственно) мутирует и начинает производить дефектный белок PrPSc [12].
Попасть в незаражённый человеческий организм прион может различными путями: при поедании плохоприготовленного мяса, содержащего PrPSc, переливании крови от инфицированного человека к здоровому, трансплантации заражённых органов и тканей.
Клиническая картина прионных заболеваний человека
Ещё одной важной особенностью прионных белков является наличие возможности принимать определённое число различных конформаций. Это обуславливает отличия в течении и симптоматике прионных заболеваний: возможны различные инкубационные периоды, повреждения разных участков коры головного мозга, нарушения различных функций нервной системы [13]. Несмотря на это, среди всех ассоциированных с действием прионов заболеваний прослеживается серия общих чёрт: поражение нервной системы, изначальное отсутствие иммунного ответа на дефектные белки PrP вследствие постоянного присутствия их «правильной» изоформы в организме [5], быстрая прогрессия болезни после окончания инкубационного периода.
Болезнь Крейтцфельда-Якоба (CJD)— редкое, но тем не менее наиболее известное прионное заболевание человека. Существует несколько форм CJD — наследственная, ятрогенная, спорадическая, вариативная, при этом первые три отличаются преимущественно способом распространения. Патоморфологические картины наследственной, ятрогенной и спорадической CJD схожи: во всех случаях наблюдаются прогрессирующие когнитивные нарушения, поражения и дисфункуция мозжечка или комбинация этих расстройств; нарушение зрения вплоть до слепоты; миоклонические припадки. В терминальной стадии появляются глобальные когнитивные нарушения, смерть наступает через 8–10 месяцев после диагностирования CJD [14]. Вариативная CJD имеет несколько более глубоких отличительных особенностей: поражает молодых людей в возрасте в среднем до 30 лет, ее начало характеризуется изменениями поведения, бессонницей, депрессией; двигательные нарушения проявляются примерно через 6 месяцев от начала заболевания в виде прогрессирующей атаксии, хореи, миоклонуса; слабоумие наступает позднее, чем при классической форме, пациент осознает свое ухудшающееся состояние. Для вариабельной БКЯ типичны не только начало в более молодом возрасте, но и средняя выживаемость, превышающая 14 месяцев [15].
Болезнь Герстмана-Штраусслера-Шейнкера (GSS)— заболевание, несколько отличающееся от CJD по нескольким признакам. Эта клиническая форма ТГЭ вызвана мутацией гена PNRP в 102-ом кодоне, приводящей к замене аминокислоты пролин на лейцин [16]. Болезнь начинается в среднем возрасте с проявления мозжечковой атаксии, речевых расстройств, деменции и измнений в поведении. К числу этих симптомов могут прибавляться диплопия, глухота, миоклонические приступы, спастичность.
Куру— прионное заболевание, эндемичное для некоторых районов Папуа-Новой Гвинеи. Основным способом распространения этой болезни был ритуальный каннибализм. Симптоматика включает в себя двигательные расстройства (тремор, массивные фасцикуляции, хореоатетоз, миоклонии). Смерть наступает через приблизительно 2 года после дебюта заболевания. В 2009 году было уставлено, что некоторые члены одного из аборигенных племён обладают врождённым иммунитетом к куру благодаря появлению у них относительно новой полиморфической модификации гена PNRP [17].
Фатальная бессоница — редкое ТГЭ, обычно связанная с наследованием аутосомно-доминантной мутации («семейная», FFI). Отмечается, что существует и спорадическая форма этого заболевания («спонтанная», FSI) [18]. В обоих случаях наблюдается следующая картина: нарушения сна, галлюцинации, вегетативная гиперактивация, двигательные нарушения, резкое и прогрессирующее снижение когнитивных способностей. Болезнь продолжается от 8 до 72 месяцев (среднее значение составляет около 18 месяцев), после чего больной умирает. Происходит стремительная гибель нейронов и астроглиоз переднего и медиального таламуса и нижних оливок с последующим поражением коры головного мозга и мозжечка. Описана стадийность заболевания [18]: начальная форма характеризуется появлением тяжёлой бессонницы, панических атак, патологической тревоги и фобий; на второй стадии развития болезни больной начинает испытывать галлюцинации; на предпоследней стадии больной утрачивает способностью ко сну и стремительно теряет вес; терминальная стадия приводит к утрате речи и смерти.
В 2013 году была обнаружена иная клиническая форма прионных заболеваний, связанная с поражением вегетативной нервной системы [19]. Заболевание ассоциировано с появлением новой мутации в гене PRNP, приводящей к укорочению прионного белка и последующим нарушением его связи с клеточными мембранами. В этом случае распространение прионных агрегатов не ограничивается ЦНС. Предположительно, имеет место миграция PrPSc в переферические нервы и внутренние органы. Серия симптомов проявляется уже в раннем возрасте: хронический понос, вегетативная недостаточность и сенсорная полинейропатия. В зрелом возрасте наступает поражение ЦНС, приводящее к появлению деменции и судорог в числе симптомов.
Вариабельная протеаза-чувствительная прионопатия (VPSPr, ВПЧП) — ещё одно новое редкое спорадическое прионное заболевание, впервые описанное в 2008 году. VPSPr схожа с GSS по особенностям PrPSc, однако в прионе VPSPr не было детектировано каких-либо мутаций гена PRNP [20]. Невосприимчивость прионных белков, вызывающих VPSPr, к действию протеаз, значительно снижена. Болезнь манифестируется расстройствами речи (афазия, дизартрия), когнитивными нарушениями, в некоторых случаях атаксией и паркинсонизмом.
Перспективы лечения прионных заболеваний
Множество исследований в этой области дают основание для возможности ингибиции репликации прионов и лечения вызывамых ими болезней.
Как было отмечено выше, иммунный ответ организма на PrPSc отсутствует. Однако эксперимент, проведённый с полученными in vitro прионами, доказал, что использование антител, выработанных на определённые антигенные детерминанты PrP, индуцирует ингибирование размножения PrPSc [21], приводящее к отсрочке заболевания. Прионное превращение также может быть остановлено с помощью «блокаторов β-структур» — пептидных последовательностей, обогащенных аминокислотой пролином и обладающих гомологичным PrPC составом [5]. Иной подход основан на использовании антисенсовых олигонуклеотидов (АСО) — коротких фрагментов нуклеиновых кислот, останавливающих трансляцию с матричной РНК за счёт образования на ней петлеобразных участков. Именно АСО на данный момент является наиболее эффективным методом ингибиции репликации прионов: эксперименты с введением АСО в спинномозговую жидкость лабораторных мышей, проведённые в Лабораториях Скалистых Гор (Rocky Mountain Laboratories), привели к отсрочке проявления прионных болезней у подопытных на 113–135 дней [22]. Астемизол, относящийся к группе блокаторов H1-гистаминовых рецепторов (H1R), обладает доказанным антиприонным действием [23]. Кроме этого, для предотвращения размножения прионов возможно использование мутаций гена PNRP, приводящих к изменениям Q171R и E219K в аминокислотной последовательности PrP: мутантные прионные белки неспособны переходить в патологическую форму [24].
В данный момент лечение прионных заболеваний может быть только симптоматическим. Использование Брефельдина А, разрущающего аппарат Гольджи и тем самым замедляющего процесс распространения PrPSc и антагонистов NMDA-рецепторов, способствующих более длительному выживанию инфицированных клеток, в терапии CJD не достигло большого успеха [25]. Попытки применения классических противовирусных средств в лечении CJD и GSS также оказались неудачными [25]. Традиционные снотворные обладают нулевой эффективностью в терапии FSI и FFI, хотя был зафиксирован случай отсрочки летального исхода при одновременном использовании ряда сильнодействующих препаратов (диазепама, кетамина, оксида азота) [26]. Терапия VPSPr может быть основана на использовании повышенной чувствительности PrPSc к действию протеаз: доставка в организм смеси специфических иммобилизованных цистеиновых протеаз, вероятно, позволит отсрочить проявление болезни и пролонгировать жизнь больного. Этиотропное лечение основных ТГЭ, судя по всему, должно быть основано на использовании вышеперечисленных или подобных им методов ингибиции прионной репликации.
Литература:
- Stanley B. Prusiner — Autobiography. NobelPrize.org.
- Alper T., Cramp W. A., Haig D. A., Clarke M. C. Does the agent of scrapie replicate without nucleic acid? // Nature. — 1967. — May (vol. 214, no. 5090). — P. 764–766.
- Taubes, Gary. The game of name is fame. But is it science? // Discover. — 1986. — December (т. 7, № 12). — С. 28–41.
- Mayo Foundation of Medical Education and Research.
- И. С. Шкундина, М. Д. Тер-Аванесян. Прионы. Успехи биологической химии, т. 46, 2006. — С. 7–9.
- Nora Whisler. Lecture 34: PRION. — 2015. — P. 22.
- Dipendra Paj Pandeya, Nimish K. Acharya and Seong-Tshool Hong. Review: The Prion and its Potentiality. // Biomedical Research. — 2010.
- Groschup M. H., Kretzschmar H. A., eds. Prion Diseases Diagnosis and Pathogeneis // Archives of Virology — New York: Springer, 2001. — Vol. Suppl 16.
- Oesch B., Westaway D., Wälchli M., et al. A cellular gene encodes scrapie PrP 27–30 protein // Cell. — Cell Press, 1985. — Vol. 40, no. 4. — P. 735–746.
- Andreas Papassotiropoulus, Adriano Aguzzi, M. Axel Wollmer, Christoph Hock. The prion gene is associated with human long-term memory. // Human Molecular Genetics. — 2005.
- Prion Diseases (Transmissible Spongiform Encephalopathies) [Online].
- Prion Clinic: Sporadic Prion Disease [Online].
- Н. Н. Заваденко, Г. Ш. Хондкарян, Р. Ц. Бамбеева, А. А. Холин, Е. Н. Саверская. Прионные заболевания человека: современные аспекты. // Журнал неврологии и психиатрии им. С. С. Корсакова. — 2018. — т. 118, изд. 6. — C. 91–92.
- ICTVdB Index of Viruses. U. S. National Institutes of Health website [Online].
- Clinical and Pathologic Characteristics | Variant Creutzfeldt-Jakob Disease, Classic (CJD) [Online].
- Arata H, Takashima H, Hirano R, et al. Early clinical signs and imaging findings in Gerstmann–Sträussler–Scheinker syndrome (Pro102Leu). // Neurology. — 2006.
- Mead S, Whitfield J, Poulter M, Shah P, Uphill J, Campbell T, Al-Dujaily H, Hummerich H, Beck J, Mein CA, Verzilli C, Whittaker J, Alpers MP, Collinge J. A Novel Protective Prion Protein Variant that Colocalizes with Kuru Exposure. // New England Journal of Medicine. — 2009.
- R. Turner. Dying To Sleep: Fatal Familial Insomnia (FFI) [Online].
- Mead S, Gandhi S, Collinge J, Caine D, Gallujipali D, Carswell Ch, Hyare H, Joiner S, Ayling H, Lashley T, Linehan JM, Al-Doujaily H, Sharps B, Revesz T, Sandberg MK, Reilly MM, Koltzenburg M, Forbes A, Rudge P, Brandner S, Warren JD, Wadsworth JDF, Wood NW, Holton JL, Collinge J. A novel prion disease associated with diarrhea and autonomic neuropathy. // New England Journal of Medicine. — 2013.
- Gambetti P, Puoti G, Zou WQ. Variably protease-sensitive prionopathy: a novel disease of the prion protein. // Journal of Molecular Neuroscience. — 2011.
- M. Enari, E. Flechsig, C. Weissmann. Scrapie prion protein accumulation by scrapie-infected neuroblastoma cells abrogated by exposure to a prion protein antibody. // Proceedings of the National Academy of Sciences. — 2001.
- G. Raymond, et al. Antisense oligonucleotides extend survival of prion-infected mice. // JCI Insight. — 2021.
- Scripps Research Institute Scientists Identify First Potentially Effective Therapy for Human Prion Disease; Unique drug screening approach for prion diseases identifies tacrolimus and astemizole as antiprion agents // Proceedings of the National Academy of Sciences. — 2013.
- K. Kaneko et al. Evidence for protein X binding to a discontinuous epitope on the cellular prion protein during scrapie prion propagation. // Proceedings of the National Academy of Sciences. — 1997.
- M. Maniz, P. Kalakoti, M. Henry, J. Thakur, R. Menger, B. Guthikonda, A. Nanda. Creutzfeldt-Jakob disease: updated diagnostic criteria, treatment algorithm, and the utility of brain biopsy. // Neurosurgical Focus. — 2015.
- Дэвид Робсон. Трагедия людей, переставших спать: можно ли им помочь? [Online] // BBC Future. — 2021.
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Особенно актуальным становится решение «прионного вопроса» в связи с нарастающей угрозой возникновения эпидемии через инвазивные медицинские операции и даже при приёме лекарственных средств.
Заторможенность
Дефицит железа
Сахарный диабет
Атеросклероз
Инсульт
9977 04 Мая
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Заторможенность: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
В основе функционирования нервной системы лежит рефлекторная дуга – путь, по которому раздражение (сигнал) от рецептора проходит к органу-эффектору. Рефлекторная дуга – это совокупность нейронных цепей, состоящих из чувствительных, вставочных и двигательных нейронов, которые обеспечивают восприятие сигнала извне, проведение его в специальные центры мозга, где происходит анализ полученной информации и генерация ответного импульса.
Таким образом, высокая скорость проведения импульса и обработки информации является одним из необходимых условий адекватной скорости функционирования нервной системы.
В связи с тем, что структура нервной системы очень сложна, состоит из множества клеток, соединенных между собой при помощи нервных отростков (нервных волокон), эта система подвержена значительному влиянию со стороны окружающей среды. Так, изменение состава жидкости, омывающей нервные клетки, изменение температуры и другие факторы могут значительно тормозить ее слаженную работу.
Разновидности заторможенности
Заторможенность проявляется замедлением скорости тех или иных нервных функций. При этом могут наблюдаться как изолированные изменения (например, замедление двигательной активности, заторможенность восприятия), так и комплексные — когда замедляются все основные функции нервной системы, включая высшую психическую деятельность.
Заторможенность может развиваться остро или постепенно. Чем внезапнее она проявляется, тем большее внимание необходимо уделить поиску причин ее развития.
Возможные причины развития заторможенности
Причин замедления нервных процессов достаточно много и одна из них —
нервное истощение
. Под этим термином подразумевают недостаточность резервов нервной ткани для выполнения ею своих функций, развивающуюся в ходе длительной напряженной работы нервной системы.
Следующим состоянием, сопряженным с заторможенностью, является кислородное голодание
центральной нервной системы. Нехватка кислорода может быть обусловлена его недостаточным поступлением извне (например, пребыванием в плохо проветриваемом помещении), нарушением газообмена в легких по причине различных
бронхолегочных заболеваний
, нарушением кровоснабжения в результате поражения сосудов, питающих центральную нервную систему, или в результате
сердечной недостаточности
, сопряженной с плохим кровоснабжением всех органов и тканей. Также нарушение доставки кислорода развивается при
анемии
– снижении концентрации гемоглобина в крови. Гемоглобин – это белок, содержащийся в эритроцитах, который связывает и переносит кислород от легких к каждой клеточке нашего организма.
В связи с тем, что потребности в кислороде у нервной системы велики, недостаточность кислорода быстро приводит к нарушению ее работы.
Еще одной причиной заторможенности является состояние
гипогликемии
— снижения уровня глюкозы в крови. Оно наблюдается при недостаточном поступлении глюкозы с пищей, при значительных физических нагрузках (когда глюкоза преимущественно тратится интенсивно работающими мышцами), при передозировке инсулина больными сахарным диабетом.
Заторможенность наступает также по причине токсического поражения нервной системы в результате отека головного мозга.
Заболевания, при которых появляется заторможенность
Среди заболеваний сердечно-сосудистой системы, которые могут быть сопряжены с недостаточным кровоснабжением головного мозга, следует выделить
атеросклеротическое поражение сосудов
, в том числе на фоне
артериальной гипертензии, сахарного диабета, сердечной недостаточности
вследствие перенесенного
инфаркта миокарда, миокардита
и других заболеваний.
К бронхолегочным заболеваниям, приводящим к недостаточному насыщению кислородом крови, относятся пневмония, хроническая обструктивная болезнь легких, бронхиальная астма
(особенно в момент приступа) и т.д.
Анемия
может развиваться по причине нарушения кроветворения (например, железодефицитная анемия), разрушения эритроцитов (гемолитическая анемия), острой или хронической кровопотери.
Гипогликемия
наблюдается не только при сахарном диабете, но и эндокринных заболеваниях, таких как недостаточность надпочечников, инсулинома, при длительных тяжелых заболеваниях печени и др.
Токсическое поражение центральной нервной системы может быть обусловлено как поступлением некоторых ядовитых веществ
извне, так и интоксикацией на фоне развития
печеночной недостаточности
(например, при циррозе печени) или
почечной недостаточности
. Синдром интоксикации сопровождает большинство
инфекционных заболеваний
, а также многие
злокачественные процессы
.
Отдельно стоит отметить жизнеугрожающие состояния, приводящие к отеку головного мозга и проявляющиеся, среди прочего, заторможенностью – к ним относятся инсульт
, сдавление головного мозга
внутричерепной опухолью
,
черепно-мозговая травма
.
К каким врачам обращаться при появлении заторможенности
В связи с тем, что причиной развития заторможенности могут быть заболевания самых различных органов и систем, при появлении данного симптома стоит обратиться к врачу общей практики, или . Эти специалисты после установления предположительной причины могут направить пациента к , , нефрологу, , гепатологу.
Диагностика и обследования при заторможенности
Диагностика заболеваний, сопровождающихся заторможенностью, начинается с опроса и осмотра больного. Зачастую этого бывает достаточно для постановки предварительного диагноза. Однако для его подтверждения необходимо провести некоторые дополнительные исследования:
- клинический анализ крови с подсчетом лейкоцитарной формулы, необходимый в первую очередь для исключения анемии;
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.
Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
[6]
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества…
Прионные заболевания (ПЗ), или трансмиссивные губкообразные энцефалопатии (ТГЭ), — группа нейродегенеративных расстройств, характеризующихся быстро прогрессирующими деменцией и двигательными нарушениями. ПЗ могут наследоваться, возникать спорадически, быть приобретенными и контагиозными [1—4], имеют длительный инкубационный период (годы), но быстро прогрессируют после манифестации клинических симптомов. Среди первых проявлений ПЗ обычно отмечаются нарушения поведения и изменения личности, миоклонус, зрительные расстройства, нарушения в двигательной и координаторной сфере. ПЗ не имеют эффективного лечения, выживаемость при спорадических и приобретенных формах во многих случаях не превышает одного года после дебюта болезни [1—4].
Поскольку ПЗ встречаются редко и начинаются с неспецифических симптомов, которые свидетельствуют о необычности поражения органов и тканей, они трудны для диагностики. Практическому врачу приходится проводить дифференциальный диагноз, который включает широкий круг различных по этиологии патологических состояний, в том числе другие нейродегенеративные, сосудистые, аутоиммунные, инфекционные, паранеопластические, токсические, метаболические и ятрогенные синдромы [5].
У человека прионы вызывают болезнь Крейтцфельдта—Якоба, болезнь Герстмана—Штраусслера—Шейнкера, фатальную семейную бессонницу и некоторые другие. В связи со вспышками ПЗ у млекопитающих высказываются опасения о возможности передачи человеку ТГЭ, в частности губкообразной энцефалопатии крупного рогатого скота (коровье бешенство), хронической истощающей болезни оленей и лосей. Более глубокое понимание патогенеза ПЗ может привести к расширению спектра этих заболеваний за счет форм, которые ранее не считались таковыми или имели неустановленную этиологию, и одновременно позволяет рассчитывать на разработку эффективной терапии ПЗ.
Прион как инфекционный агент не привносит в организм новый генетический материал, а представляет собой измененную форму (за счет аномальной трехмерной структуры) одного из присутствующих в нем белков с самоподдерживающимися свойствами, т. е. способностью катализировать конформационное превращение гомологичного ему нормального клеточного белка в себе подобный (прион) [1].
Термин «прион» появился в середине XX века. Природа губкообразных энцефалопатий долгое время оставалась неустановленной. В 60-е годы английские исследователи T. Alper и соавт. [6] и J. Griffith [7] выдвинули гипотезу, что некоторые ТГЭ вызываются патогенами, состоящими исключительно из белков. Они обнаружили, что возбудитель скрейпи у овец (англ
.: scrapie — почесуха) и болезни Крейтцфельдта—Якоба обладает необычными свойствами и исключительной устойчивостью к ионизирующему излучению. Это поставило под сомнение предположение, что данные заболевания вызываются вирусом, хотя прионы, как и вирусы, способны увеличивать свою численность, используя функции живых клеток. Доза радиации, необходимая для уничтожения половины частиц инфекционного агента, зависит от их размера: чем меньше такая частица, тем меньше вероятность попадания в нее заряженной частицы. На этом основании было установлено, что по своим размерам прионы значительно меньше вирусов.
В отношении состава прионов высказывались различные мнения. Основной стала гипотеза об их белковом составе, впервые выдвинутая J. Griffith [7] и более подробно обоснованная S. Prusiner [8, 9]. Именно после этого был введен термин «прион» (prion — proteinacious infectious particle, белковая инфекционная частица, или PrP — prion protein, прионный белок). В 1982 г. S. Prusiner [8] выделил этот агент из мозга больных животных, а затем изучил его свойства. Инфекционный агент состоял из одного белка. На основании полученных экспериментальных данных была сформулирована концепция белков-прионов [8, 9], которая первоначально была встречена с большим скептицизмом, а затем стала общепринятой.
Все известные на сегодняшний день ПЗ млекопитающих вызываются белком PrP. Его форма с нормальной третичной структурой обозначается как PrPC (от англ
.: common — обычный или cellular — клеточный). Патологическая форма белка, обусловливающая его инфекционность, названа PrPSc (от
англ
. scrapie — почесуха овец (скрейпи), по названию одного из первых заболеваний с установленной прионной природой) или PrPTSE (от
англ
.: Transmissible Spongiform Encephalopathies — трансмиссивные губкообразные энцефалопатии).
Основные положения концепции S. Prusiner [8, 9] сводятся к следующему [1]:
1. Инфекционным агентом является белок PrPSc, который реплицирует себя в отсутствии нуклеиновой кислоты.
2. Превращение белка из нормальной формы PrPC в инфекционную форму PrPSc происходит в виде конформационного перехода разными путями:
— спонтанно (спорадические формы);
— на основе поступления извне патологической формы PrPSc (приобретенные формы);
— в результате мутаций в гене PRNP
, обусловливающих образование PrPSc из PrPC (наследственные формы).
Прионы — единственные известные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот. Инфекционная изоформа PrPSc способна превращать нормальный белок PrPC в инфекционную изоформу, изменяя его конформацию (третичную структуру). Появившиеся в результате такой трансформации прионы начинают перестраивать новые молекулы белка, и запускается цепная реакция, в ходе которой образуется огромное количество неправильно «свернутых» молекул. Это в свою очередь изменяет взаимодействие PrPC с другими белками. Исследования структуры PrPC показали, что он состоит приблизительно из 40% α-спиралей и 3% β-слоев; в PrPSc вместо α-спиралей преобладают β-слои [1]. Высокое содержание β-слоев коррелирует с устойчивостью PrPSc к ферментативному расщеплению и его инфекционностью.
Установлено, что нормальная и патологическая формы прионного белка неотличимы друг от друга по аминокислотной последовательности, но имеют разную конформацию. Нормальный белок хозяина PrPC находится на поверхности многих клеток, в частности в нейронах. Структурно-модифицированная форма PrPSc при попадании в здоровые клетки инициирует цепную реакцию и приводит к преобразованию PrPC в PrPSc. Прионная форма белка чрезвычайно стабильна и накапливается в пораженной ткани, вызывая ее повреждение и в конечном счете — гибель. Стабильность прионной формы означает, что прионы устойчивы к денатурации под действием химических и физических агентов [1].
Вслед за определением первичной структуры PrPС был идентифицирован кодирующий его ген PRNP
, который присутствует в геномах всех млекопитающих, птиц и рыб. У человека этот ген локализован в коротком плече хромосомы 20 (20р), имеет протяженность 16 тыс. н.п. и содержит 2 экзона. Ген является высококонсервативным, и наивысшие уровни его экспрессии отмечены в нейронах ЦНС. Он кодирует полипептид длиной 253 аминокислотных остатка, который в процессе созревания укорачивается клеточными ферментами. Зрелая форма PrP состоит из 208 аминокислотных остатков и имеет молекулярную массу 35—36 кДа [10]. Генетические формы ПЗ обусловлены мутацией гена
PRNP
. При болезни Крейтцфельдта—Якоба описано более 50 мутаций [11], чаще всего в кодонах 178, 200 и 210, при болезни Герстмана—Штраусслера—Шейнкера мутации возникают в кодонах 102 и 117, семейной фатальной бессоннице — в кодонах 129 и 178. Помимо мутаций описан ряд вариантов полиморфизма [12].
Экспрессируемый PRNP
белок PrPС является якорным гликозилфосфатидилинозитолом, клеточно-поверхностным гликопротеином. PrPС (нормальный мембранный белок млекопитающих) входит в состав клеточных мембран в разных тканях — в основном в нейронах ЦНС, лимфоретикулярной ткани, клетках иммунной системы [1]. Функции белка PrPС полностью не раскрыты. По-видимому, он играет важную роль в поддержании сохранности нейронов и глии в отношении окислительного стресса, причастен к процессам регуляции содержания внутриклеточного кальция (Са+) в нейронах, метаболизма меди, участвует в клеточной адгезии, передаче внутриклеточных сигналов, обеспечении нормального функционирования синапсов и передачи сигналов в нервной ткани, а также в поддержании в клетках, тканях, органах и организме в целом циркадных (циркадианных) ритмов [3, 13].
При переходе белка PrPC в прионное состояние PrPSc его α-спирали превращаются в β-слои [1, 4], изменяется конформация. Такие ненормальные изоформы объединяются в высокоструктурированные амилоидные волокна, которые, скапливаясь, формируют бляшки. Конец каждого волокна служит своеобразной осью, к которой могут прикрепляться свободные белковые молекулы, в результате чего фибрилла растет. В большинстве случаев присоединяться могут только молекулы PrP, идентичные по первичной структуре PrPSc (поэтому обычно передача прионов видоспецифична). Однако возможны и случаи межвидовой передачи прионов [14].
Как было сказано выше, существуют три варианта возникновения ПЗ: прямое заражение, наследственные и спорадические (возникающие спонтанно) формы. В ряде случаев развитие ПЗ определяется комбинацией этих факторов (например, заражением и предрасположенностью, определяемой генотипом) [1, 15]. В большинстве случаев (около 85%) ПЗ возникают спонтанно по невыясненным причинам, на долю наследственных форм приходится примерно 10% случаев, остальные случаи вызваны прионным заражением [15].
Заражение как человека, так и животных чаще всего бывает алиментарным. Из кишечника прионы транспортируются в кровь и лимфу. В ЦНС прионы проникают гематогенным путем, преодолевая гематоэнцефалический барьер, что подтверждается передачей ПЗ при переливании крови [16]. Кроме гематогенного распространения, прионы могут попадать в головной мозг по блуждающему и периферическим нервам (нейроинвазия) [17].
Ранее считалось, что ЦНС — единственная ткань, в которой накапливаются прионы, но было подтверждено, что проникновение прионов в мозг происходит после их репликации в селезенке, аппендиксе, миндалинах и других лимфоидных тканях. И хотя ПЗ — неврологические заболевания, критические события в их патогенезе происходят в периферических лимфоидных органах [18]. Лимфоидные органы поражаются на ранних стадиях ПЗ, а селезенка и лимфатические узлы являются первичными точками репликации PrPSc после заражения и также значительно повреждаются. В экспериментах показано, что удаление селезенки и другие воздействия на периферические лимфоидные структуры задерживают дебют клинических проявлений ПЗ [18].
Под действием прионов в головном мозге формируются фибриллы, развиваются амилоидоз (внеклеточный диспротеиноз, характеризующийся отложением амилоида с развитием атрофии и склероза ткани) и астроглиоз (разрастание астроцитарной нейроглии, гиперпродукция глиальных волокон) при отсутствии инфильтративных воспалительных реакций. В результате происходят гибель нейронов, образование вакуолей, белковых/амилоидных агрегатов и возникают губкообразные изменения головного мозга [19—21]. После инфицирования и репликации в ЦНС прионы распространяются по периферическим нервам к другим тканям, где происходит вторичная прионная репликация [20, 21].
Прионы поражают разные виды млекопитающих, при этом белок PrP у всех видов очень схож. Но из-за небольших различий между PrP у разных видов передача ПЗ от одного вида к другому нехарактерна, т. е. существует видовой барьер [1, 22]. Тем не менее вариант болезни Крейтцфельдта—Якоба у человека вызывается прионом, обычно поражающим коров и вызывающим ТГЭ крупного рогатого скота, который передается через зараженное мясо.
Клинические формы ПЗ
В настоящее время известны следующие клинические формы ПЗ человека: болезнь Крейтцфельдта—Якоба (БКЯ), основной тип; вариант БКЯ (вБКЯ); болезнь Герстмана—Штраусслера—Шейнкера; вариабельная протеаза-чувствительная прионопатия; фатальная бессонница и фатальная семейная бессонница; куру; ПЗ, ассоциированное с диареей и вегетативной нейропатией.
БКЯ
— наиболее распространенное ПЗ человека, на долю которого приходится около 85% всех случаев П.З. Ведущим клиническим проявлением БКЯ является быстро прогрессирующая деменция, возникающая без явных причин и сопровождающаяся поведенческими изменениями (особенно у более молодых пациентов), нарушениями высших психических функций (афазия, амнезия и дефицит внимания), миоклонусом, пирамидными расстройствами [23].
Классическая клиническая триада БКЯ включает быстро прогрессирующую деменцию, миоклонус и атаксию. Среди двигательных расстройств чаще всего наблюдаются миоклонические гиперкинезы (возникают спонтанно или провоцируются слуховой и тактильной стимуляцией), но также встречаются экстрапирамидные нарушения: дистония, хореоатетоз, тремор, гемибаллизм, атипичный паркинсонизм [24].
Другие неврологические нарушения представлены зрительными расстройствами (диплопия, затуманенность или нечеткость зрения, дефекты полей зрения, зрительная агнозия, возможно формирование корковой слепоты), эпилептическими приступами, изменениями поведения, периферической нейропатией, на поздних стадиях — акинетическим мутизмом. Психиатрические симптомы отмечаются у 80—90% пациентов и возникают в начале заболевания у 20—26%. Среди них бессонница, тревога, депрессия, раздражительность, галлюцинации, психоз, когнитивные расстройства [25].
Подтверждение БКЯ с помощью лабораторных методов основывается на результатах магнитно-резонансной томографии (МРТ) головного мозга (при диффузионно-взвешенной МРТ или в режиме FLAIR обнаруживаются характерные изменения сигнала на уровне хвостатого ядра, бледного шара, кортикальных зон), электроэнцефалографии (ЭЭГ) (типичны периодические комплексы острых волн на более медленном и низкоамплитудном фоне), идентификации в спинномозговой жидкости белковых маркеров возбудителя (в частности, белка 14−3-3) с помощью иммуноблоттинга, нового метода вибрационно-индуцированной конверсии в режиме реального времени (RT-QUIC), посредством которого обнаруживается минимальное количество прионного белка [21, 26].
Диагноз верифицируется при гистохимическом исследовании микропрепаратов из биоптата головного мозга, при этом могут быть установлены наследственные случаи и другие генетические формы ПЗ (фатальная семейная бессонница и болезнь Герстмана—Штраусслера—Шейнкера).
Но поскольку не во всех отделах головного мозга могут быть обнаружены типичные для БКЯ гистологические изменения, подтверждение диагноза после проведения биопсии может дать неубедительные результаты. Поэтому нейрохирурги стремятся получить образцы для исследования из тех областей мозга, в которых имеются наиболее значительные изменения по данным МРТ (чаще это глубокие субкортикальные структуры) [15].
Различают несколько форм БКЯ: спорадическая, генетическая (семейная), ятрогенная и вБКЯ. Независимо от формы течение заболевания характеризуется быстрым прогрессированием с фатальным исходом. Средняя выживаемость обычно колеблется от 6 мес до года [12, 15].
Спорадическая БКЯ
встречается значительно чаще остальных форм — в 85% случаев [15]. Заболеваемость составляет 1 случай на 1 млн населения в год. Нейродегенеративный процесс запускается спонтанно в результате соматической генной мутации или случайных структурных изменений в PrP, приводящих к образованию PrPSc. В отличие от вБКЯ, клинические и патоморфологические проявления более гетерогенны, что может быть связано с существованием различных молекулярных фенотипов. Начинается заболевание обычно в возрасте 60—70 лет, около 90% пациентов умирают в течение одного года.
Генетическая (семейная) БКЯ. Порядка 5—15% случаев БКЯ являются генетическими (семейными), с аутосомно-доминантным типом наследования и высокой пенетрантностью, связанными с мутациями в гене PRNP
. Семейная БКЯ имеет сходные клинические, нейрорадиологические и лабораторные характеристики со спорадической формой. Описаны более 50 мутаций
PRNP
, частота их встречаемости увеличивается с возрастом [11].
Ятрогенная БКЯ
может передаваться путем трансплантации трупной роговицы или твердой мозговой оболочки, при использовании стереотаксических внутримозговых электродов или применении гормона роста, приготовленного из гипофиза человека. Клиническая картина сходна с таковой при спорадической БКЯ [12, 15]. Инкубационный период зависит от места инокуляции. При использовании загрязненных электродов, которые накладываются непосредственно на мозг, он самый короткий (16—28 мес), а после периферического введения гормона роста длится от 5 до 30 лет [27].
Имеются описания 3 случаев передачи БКЯ в результате переливания крови от донора, у которого был диагностирован вБКЯ во время вспышки этого заболевания в Великобритании [28].
вБКЯ
развивается после употребления в пищу говядины, зараженной прионами. В 1986 г. в Великобритании вспыхнула эпизоотия ТГЭ коров, также названной «коровьим бешенством», которая привела к гибели более чем 160 000 голов крупного рогатого скота [29]. Это новое заболевание было вызвано использованием пищевых добавок мясокостной муки, когда из-за слабо контролируемых правил переработки побочных продуктов животного происхождения PrPSc от зараженных скрейпи овец и другого крупного рогатого скота с ТГЭ попадал в корм для коров. Обычно в технологию получения такой муки после процессов тщательного измельчения исходного сырья включена обработка активными жирорастворителями, а также термообработка при температуре 130 оС. Однако в конце 70-х годов предприниматели, решив повысить питательную ценность мясокостной муки, снизили режим термообработки до 110 оС, а также уменьшили количество веществ, экстрагирующих жир. Именно эти изменения способствовали эпизоотии крупного рогатого скота [3].
Доказано, что ТГЭ у коров привела к появлению нового типа БКЯ, получившего название «вариант БКЯ» [29]. Первые случаи вБКЯ были зарегистрированы в 1995 г., когда заболевание диагностировали у 2 британских подростков [30, 31]. Из-за длительного инкубационного периода связь между заболеванием и зараженным мясом в Великобритании не была установлена до тех пор, пока заболеваемость ТГЭ у коров не переросла в эпидемию. Эпидемия ТГЭ была взята под контроль после массивного убоя скота и изменений в технологии производства, которые резко сократили загрязнение мяса компонентами нервной ткани. В Великобритании ежегодное число новых случаев вБКЯ, которое достигло пика в 2000 г., неуклонно снижается, и в 2013 г. был подтвержден только 1 случай заболевания [15, 32].
Большинство случаев вБКЯ диагностировано в Великобритании, их число составило около 200 в 2015 г., по сравнению с примерно 60 случаями в других странах [15, 32]. У всех пациентов вБКЯ развился после употребления в пищу мяса, полученного от крупного рогатого скота, заболевшего ТГЭ. Но, несмотря на широкое распространение ТГЭ, поразившего сотни тысяч голов крупного рогатого скота, относительно у немногих людей, которые употребляли в пищу мясо больных животных, развился вБКЯ [15, 33].
Инкубационный период (время между употреблением в пищу зараженной говядины и манифестацией симптомов) был длительным: большинство пациентов были заражены в конце 80-х годов, а пик заболеваемости пришелся на начало 2000-х, т. е. инкубационный период составил 11—12 лет. В последних диагностированных случаях инкубационный период достигал от 12 до более 20 лет [32, 33].
Клинические и патоморфологические проявления при вБКЯ имеют отличия от других форм БКЯ. Болезнь поражает молодых людей в возрасте в среднем до 30 лет, ее начало характеризуется изменениями личности: больной утрачивает прежние интересы, начинает сторониться близких людей, у него развиваются тревожное состояние, бессонница, депрессия. Двигательные нарушения проявляются примерно через 6 мес от начала заболевания в виде прогрессирующей атаксии, хореи, миоклонуса. Слабоумие наступает позднее, чем при классической форме, пациент осознает свое ухудшающееся состояние. Довольно быстро он теряет способность самообслуживания. Для вБКЯ типичны не только начало в более молодом возрасте, но и средняя выживаемость, превышающая 14 мес [15, 32, 33]. Вероятно, что различия в выживаемости отчасти связаны с возрастом пациентов.
При этом развитие вБКЯ обусловлено не только воздействием патогена из зараженного мяса, но и генетической предрасположенностью, одним из факторов которой является полиморфизм в кодоне 129 гена PRNP
, определяющий встраивание аминокислоты валина или метионина в соответствующем положении прионного белка. Во всех подтвержденных случаях выявлялось гомозиготное состояние по данному полиморфизму с встраиванием метионина. Предполагается, что повышенная предрасположенность к развитию ПЗ у гомозигот по кодону 129 обусловлена абсолютной гомологией молекул прионного белка, что облегчает межмолекулярное взаимодействие и, следовательно, конверсию PrPC в PrPSc [29]. Напротив, гетерозиготность (валин/метионин) в кодоне 129 имеет определенный протективный эффект, что подтверждается более поздним (на 10—20 лет) началом болезни у гетерозигот по сравнению с гомозиготами при некоторых наследственных формах ПЗ [12, 33].
Болезнь Герстмана—Штраусслера—Шейнкера
, или подострая губкообразная энцефалопатия, наследуется по аутосомно-доминантному типу и обычно развивается в среднем возрасте. Средняя продолжительность жизни после дебюта (5 лет) превышает таковую при БКЯ. По сравнению с БКЯ распространенность болезни Герстмана—Штраусслера—Шейнкера примерно в 100 раз ниже [3, 12].
Болезнь начинается с развивития мозжечковой атаксии с трудностями при ходьбе и удерживании равновесия, дизартрии, к которым присоединяются прогрессирующие изменения личности и деменция. Могут отмечаться двоение в глазах, парез взора, глухота, пирамидные симптомы (спастичность). Миоклонии встречаются гораздо реже, чем при БКЯ. Продолжительность жизни составляет от 2 до 10 лет.
При наличии характерных симптомов и семейного анамнеза у пациентов молодого возраста (моложе 45 лет) более вероятен синдром Герстмана—Штраусслера—Шейнкера. Диагноз подтверждается данными генетического исследования [3, 12, 33].
Вариабельная протеаза-чувствительная прионопатия
— редкое ПЗ, описанное в 2008 г., диагностируется в 2—3 случаях на 100 млн населения [34]. Вариабельная протеаза-чувствительная прионопатия сходна с болезнью Герстмана—Штраусслера—Шейнкера в отношении накопления аномального прионного белка PrPSc и особенностей изменений в головном мозге, но в отличие от болезни Герстмана—Штраусслера—Шейнкера в гене этого белка не было выявлено мутаций. Клинические проявления отличаются от БКЯ, а PrPSc менее устойчив к расщеплению протеазами, причем в некоторых случаях чувствительность к действию протеаз больше, чем в других, что нашло отражение в названии «вариабельная протеаза-чувствительная». Заболевание манифестирует расстройствами психики, речи (афазия, дизартрия), когнитивными нарушениями. Могут развиваться атаксия и паркинсонизм. Средний возраст начала заболевания составляет 70 лет, выживаемость — около 2 лет. Примерно 40% пациентов имеют отягощенный семейный анамнез по деменции [34].
Фатальная бессонница
— редкое наследственное или спорадическое ПЗ, вызывающее нарушения сна, двигательные расстройства и приводящее к летальному исходу. Фатальная бессонница обычно связана с аутосомно-доминантной мутацией. Имеются описания около 40 семей, пораженных этой болезнью [33]. Генетическое исследование позволяет подтвердить диагноз. Средний возраст дебюта составляет около 40 лет (от 20 до 60 лет), продолжительность жизни — 8—72 (в среднем 18,4) мес. Недавно было опубликовано описание верифицированной спорадической фатальной бессонницы у подростка 13 лет [35].
Ранние симптомы фатальной бессонницы включают возрастающие трудности с засыпанием и поддержанием сна, а также снижением когнитивных способностей, атаксией и психическими нарушениями (изменения поведения, аффективные расстройства). К ним присоединяются симптомы симпатической гиперактивации: артериальная гипертензия, тахикардия, гипертермия, потливость.
Описана стадийность течения заболевания [33]. На начальном этапе пациент страдает от все более тяжелой бессонницы, панических атак и фобий (длится в среднем 4 мес). В дальнейшем панические атаки становятся тяжелыми, к ним присоединяются галлюцинации (в среднем 5 мес). Далее наступает полная неспособность спать, сопровождающаяся быстрой потерей массы тела (в среднем 3 мес). Наконец пациент утрачивает речь, не реагирует на окружающее, а затем умирает (в среднем 6 мес).
Куру
— редкое ПЗ, эндемичное для высокогорных районов Папуа — Новой Гвинеи и аборигенов племени форе, распространялось через ритуальный каннибализм. Хотя последние ритуалы, связанные с каннибализмом, закончились в середине XX века, в период между 1996 и 2004 гг. были зарегистрированы 11 новых случаев куру, поэтому предполагается, что инкубационный период заболевания может длиться более 50 лет [33].
Первыми симптомами куру являются тремор (напоминающий дрожь) и атаксия. Позднее развиваются деменция и двигательные расстройства (хореоатетоз, миоклонии, массивные фасцикуляции). Смерть обычно наступает в течение 2 лет после появления симптомов, ее причиной бывают пневмонии или инфекции, вызванные пролежнями.
В 2009 г. было установлено, что некоторые члены племени форе имеют врожденный иммунитет к куру, благодаря появившемуся у них сравнительно недавно новому полиморфизму гена PRNP
[36].
ПЗ, ассоциированное с диареей и вегетативной нейропатией
, — новая клиническая форма, описанная в 2013 г. у 11 членов британской семьи, проявляется симптомами поражения вегетативной нервной системы, а не ЦНС [37]. Заболевание связано с новой мутацией Y163X в гене
PRNP
, приводящей к укорочению прионного белка, в результате чего у него отсутствует «якорь», связывающий белок с клеточными мембранами; вероятно, это создает предпосылки для его миграции в другие ткани. Поэтому накопление прионных амилоидов не ограничивается ЦНС, а распространяется на периферические нервы и внутренние органы. Периферические симптомы преобладают в начале болезни, а признаки поражения ЦНС возникают позже.
Это ПЗ показывает, насколько значительно новая мутация может изменять ткани, где оседают аномальные белки, вызывая симптомы болезни. Диагноз П.З. следует исключать у больных с необъяснимой хронической диареей в сочетании с нейропатией, а также в семейных случаях, напоминающих амилоидную полинейропатию.
Симптомы проявляются в молодом взрослом возрасте, включают хронический водянистый понос, вегетативную недостаточность (например, задержку мочи, недержание мочи, ортостатическую гипотензию) и, прежде всего, сенсорную полинейропатию. В возрасте 40—50 лет у больного появляются снижение когнитивных функций и судорожные приступы. Болезнь прогрессирует в течение десятилетий, после появления симптомов продолжительность жизни пациентов может достигать 30 лет [37].
Профилактика ПЗ
Сегодня не существует методов лечения П.З. Все известные ПЗ человека фатальны, и назначения сводятся к поддерживающей терапии. Родственникам пациентов с семейным анамнезом ПЗ рекомендуется генетическое консультирование.
Ведутся разработки специальных вакцин для животных, что в перспективе должно помочь в создании вакцины против ПЗ для человека [38]. Методами генной инженерии была получена корова, лишенная необходимого для образования прионов гена, т. е. теоретически она обладает иммунитетом к ТГЭ [38].
В связи с отсутствием эффективного лечения необходимы мероприятия по профилактике трансмиссивных форм П.З. По данным современных исследований, основной путь приобретения ПЗ — употребление зараженной пищи. Считается, что прионы присутствуют в моче, слюне и других биологических жидкостях и тканях организма, а также могут долго сохраняться в окружающей среде в почве и останках животных.
Заражение прионами может произойти при использовании нестерильных хирургических инструментов. Прионы не восприимчивы к стандартным методам дезинфекции, поэтому могут представлять опасность для других пациентов и хирургов, патологоанатомов или лаборантов, которые контактируют с зараженными тканями или инструментарием. Медики, контактирующие с биологическими жидкостями и тканями больных с подозрением на ПЗ, должны работать в перчатках, избегать контакта зараженного материала со слизистыми оболочками. При попадании зараженного материала на кожу сначала проводят ее дезинфекцию 4% раствором гидроксида натрия в течение 5—10 мин, затем промывают проточной водой [39].
Заражение можно предупредить, соблюдая меры предосторожности при работе с инфицированными тканями и используя соответствующие методики для очистки контаминированного инструментария. Для обеззараживания материалов и инструментов рекомендуется автоклавирование при 132 °C в течение 1 ч или стерилизация в однонормальном растворе гидроксида натрия или 10% растворе гипохлорида натрия в течение 1 ч. Стерилизация должна приводить к денатурации прионов (путем гидролиза или разрушения третичной структуры) до состояния, в котором они будут неспособны изменять конфигурацию других белков [39]. Прионы устойчивы к воздействию протеаз, высокой температуры, радиации и обработке формалином, хотя эти меры и снижают их инфективность [40]. Показана эффективность озоновой стерилизации в качестве метода деактивации прионов в контаминированной воде [41].
Проводятся исследования c применением генно-модифицированных организмов, в частности дрожжевых грибков, а также ряда бактериальных штаммов для ферментированной биотрансформации органических пищевых отходов (в том числе содержащих прион — возбудитель скрейпи овец) с эффектом редуцирования прионной активности и, как следствие, профилактики повторного заражения животных и людей [42].
В современной медицине находят применение лекарственные биопрепараты, для изготовления которых применяются ткани животных. Существует ли потенциальный риск возникновения ПЗ у применяющих их пациентов? В связи с этим исключительно актуальны вопросы обеспечения и оценки безопасности таких препаратов для человека, которые должны решаться с помощью современных технологий.
Биологическая безопасность биопрепаратов на основе тканей животных от загрязнения прионами обеспечивается специально разработанными процедурами, соответствующими требованиям Европейского медицинского агентства (Guideline 410/01 Rev.2), а также требованиям Европейской фармакопеи (Eur. Ph. 7.0, 01/2008:50107, п. 5.1.7 «Вирусная безопасность» и Eur. Ph. 7.0, 01/2008:50208, п. 5.2.8. «Снижение риска заражения животных вирусом губчатой энцефалопатии через человеческие и ветеринарные лекарственные препараты») к минимизации рисков передачи прионов через фармакологические продукты, предназначенные для человека и использования в ветеринарии.
является производителем современных лекарственных препаратов, в том числе пептидергического ноотропного препарата кортексин. «Герофарм» закупает сырье животного происхождения, используемое для производства сухого экстракта — фармацевтической субстанции. В качестве сырья берется материал от молодых здоровых животных, который проходит самый жесткий отбор по географическим критериям и используется только после подтверждения вирусной безопасности и получения ветеринарного сертификата, выданного Государственной службой по обеспечению ветеринарной безопасности.
Основу производства препарата кортексин составляют современные технологические процессы, направленные на выделение из тканей сырья низкомолекулярных растворимых в воде пептидов, молекулярная масса которых составляет менее 10 кД. Согласно технологии, закрепленной в промышленном регламенте, производство препарата включает водную экстракцию комплекса гидрофильных полипептидов из сухого экстракта с последующей ультрафильтрацией через половолоконный фильтр с отсекающей способностью 8 кД, а также окончательную фильтрацию раствора через мембранные фильтры с размером пор 0,45 и 0,22 мкм перед сублимационной сушкой. Ультрафильтрация позволяет полностью исключить из конечного препарата пептиды с молекулярной массой более 10 кД, при этом, как известно, молекулярная масса прионов составляет 33—35 кД, а молекулярного фрагмента, устойчивого к протеолизу, — 27—30 кД.
Важно подчеркнуть, что субстанция препарата (кортексин экстаракт сухой) является полупродуктом и непосредственно не используется для приготовления стерильного лекарственного средства, а подвергается обработке на дополнительных технологических стадиях, в результате которых в состав готовой лекарственной формы (лиофилизат) входят только водорастворимые фармакологически активные полипептиды с молекулярной массой менее 10 кД.
Таким образом, основываясь на описанных выше физико-химических свойствах прионов и учитывая условия получения пептидного субстрата, используемого при производстве лекарственного препарата кортексин, можно с уверенностью исключить возможность присутствия не только PrPSc, но и фрагментов молекулы этого белка в растворе, который применяется для получения препарата. Для каждой серии готовой продукции в рамках рутинного мониторинга производителем выполняется анализ на отсутствие высокомолекулярных белков с использованием валидированных методик контроля качества, что подтверждает высокую биологическую безопасность кортексина от загрязнения прионами.
Изучение прионов и вызываемых ими заболеваний является сравнительно новой и быстро развивающейся областью биомедицинских исследований. Все возрастающий интерес к ПЗ обусловлен, с одной стороны, тем, что прионы представляют собой совершенно новый тип инфекционных агентов, выявление которых можно сравнить по своему значению с обнаружением Антони ван Левенгуком мира одноклеточных микроорганизмов и затем — с открытием Дмитрием Иосифовичем Ивановским царства вирусов. С другой стороны, в настоящее время медицина не располагает эффективными средствами лечения данной патологии, а длительный инкубационный период ПЗ с развитием нейродегенеративных изменений и неотвратимым летальным исходом навевает мистический ужас. Поэтому важное значение имеет профилактика заражений прионами как алиментарным (употребление зараженных мясных продуктов), так и трансмиссивным ятрогенным (применение лекарственных биопрепаратов, получаемых из тканей животных) путями. Надежное и строго регламентируемое производство пептидергических биопрепаратов вселяет оптимизм относительно безопасности этих препаратов наряду с их эффективностью.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail; https://orcid.org/0000-0003-0103-7422
Литература
- Абрамова З.И. Исследование белков и нуклеиновых кислот. Казань: Казанский государственный университет, 2006. — 157 с.;
- Новиков Д.К., Генералов И.И., Данющенкова Н.М. Медицинская микробиология. Витебск: ВГУ, 2010. — 597 с.;
- Прудникова С.В. Микробиология с основами вирусологии. Красноярск: ИПК СФУ, 2008;
- Поздеев О.К., Покровский В.И. Медицинская микробиология. М.: Гэотар-мед, 2001. — 765 с.;
- S. B. Prusiner. (2012). A Unifying Role for Prions in Neurodegenerative Diseases. Science
.
336, 1511-1513; - V. Beringue, L. Herzog, E. Jaumain, F. Reine, P. Sibille, et. al.. (2012). Facilitated Cross-Species Transmission of Prions in Extraneural Tissue. Science
.
335, 472-475; - Carolina Pola. (2012). Prion escape to spleen. Nat Med
.
18, 360-360; - Элементы: «10 фактов о прионах и амилоидах»;
- Элементы: «Геометрия белковых тел»;
- Charles Weissmann. (2012). Mutation and Selection of Prions. PLoS Pathog
.
8, e1002582.