Клинические формы и подходы к лечению печеночной энцефалопатии у больных циррозом
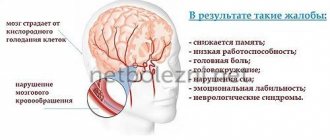
Патогенез В развитии ПЭ принимают участие два основных патогенетических механизма: 1) острое или хроническое заболевание печени, сопровождающееся выраженным снижением ее детоксицирующей функции; 2) формирование функциональных или анатомических шунтов между системами портального и общего кровообращения, ведущее к проникновению токсических продуктов кишечного происхождения в головной мозг. Знание указанных механизмов дает врачу возможность в определенной степени предвидеть развитие ПЭ у пациента с тем или иным патологическим состоянием. Так, при фульминантной печеночной недостаточности ПЭ наблюдается почти у всех больных, после хирургического наложения портокавального шунта – у 25–40%. У больных циррозом в патогенезе ПЭ участвуют как «внутренний», так и «внешний» механизмы, что ведет к развитию клинически манифестной энцефалопатии у 30–50%, а латентной – у 50–70%. Знание патогенетических факторов ПЭ важно для выбора оптимального метода лечения (табл. 1). Многолетнее изучение патогенеза ПЭ позволяет прийти к выводу, что, по всей видимости, рассмотренные механизмы действуют в комплексе. Комбинация неблагоприятных факторов у больного с острой или хронической патологией печени ведет к развитию комплекса нервно–психических нарушений, обозначаемых как ПЭ. Вместе с тем многочисленные результаты исследований дают основание утверждать роль аммиака, как одного из важнейших нейротоксических метаболитов. Наиболее значительные количества аммиака образуются вследствие дезаминирования аминокислот в печени; в качестве дополнительных его источников могут выступать мышцы, почки и пищеварительный тракт. Являясь основным источником аммиака, печень в то же время служит главным местом его обезвреживания за счет синтеза мочевины в функционирующем в перипортальных гепатоцитах орнитиновом цикле. Меньшая часть аммиака участвует в синтезе глутамина в перивенозных гепатоцитах, мышцах и головном мозге. Заболевания печени ведут как к снижению скорости детоксикации аммиака, так и к избыточному поступлению последнего в системную циркуляцию за счет портокавального шунтирования. Накопление аммиака в головном мозге обусловливает нарушение синтеза белков астроцитов, снижение активности нейрональных хлорных каналов, подавление образования АТФ и возбуждающих нейротрансмиттеров – глутамата и аспартата. Важное значение для клинициста имеет знание разрешающих (триггерных) факторов, действие которых приводит к дебюту или углублению выраженности ПЭ (табл. 2). Клинические формы ПЭ представляет собой гетерогенную группу состояний, которая подразделяется на 5 форм (табл. 3). Цирроз печени вследствие развития портальной гипертензии и печеночной недостаточности ведет к портосистемной ПЭ (ПСЭ) в одном из указанных вариантов, которые могут переходить один в другой. Вместе с тем ПСЭ у больных циррозом следует дифференцировать с псевдо–ПСЭ, описанной H. Kalk в 1958 г. и известной также под названиями «ложная печеночная кома» и «электролитная кома». Ведущая роль в патогенезе псевдо–ПСЭ принадлежит электролитному дисбалансу, представленному гипокалиемией и/или гипонатриемией, а также гипомагниемией, обусловливающим гипотоническую дегидратацию клеток головного мозга. Наиболее частая причина «электролитной комы» – передозировка петлевых диуретиков. Латентная ПСЭ трудна для диагностики, так как характеризуется отсутствием субъективной и объективной клинической симптоматики, а также изменений при регистрации спонтанной электроэнцефалограммы (ЭЭГ). Однако распознавание этой формы крайне важно по двум причинам: • частота латентной ПСЭ у больных циррозом достигает 50–70%, то есть представляет собой наиболее частое осложнение заболеваний печени вне зависимости от этиологии; • латентная ПСЭ сопровождается неадекватной реакцией пациента в экстремальных условиях, в том числе при вождении автомобиля, что сопряжено с повышенным риском создания аварийных ситуаций. С целью ранней диагностики ПСЭ в клинической практике широко применяются психометрические тесты: связи чисел (табл. 4), число–буква, линии, почерка, арифметический и др. Следует учитывать, что за простотой и удобством психометрических тестов скрываются определенные недостатки, к которым в первую очередь относится влияние на их результаты многочисленных экзогенных и эндогенных факторов. Вероятность гиподиагностики ПСЭ можно свести к минимуму, используя несколько тестов у одного пациента и интерпретируя результаты в комплексе. Острая и подострая рецидивирующая формы ПСЭ проявляются клинической манифестацией энцефалопатии у больного хроническим заболеванием печени. Как правило, у таких пациентов имеется фоновая латентная ПСЭ, которая остается нераспознанной при отсутствии целенаправленного диагностического поиска. Манифестация может быть различной степени выраженности – от I до IV стадии (ниже) и нередко, хотя и не всегда, обусловлена действием одного или нескольких триггерных факторов. Элиминация разрешающего фактора и терапевтические мероприятия обычно ведут к ликвидации всех клинических симптомов. Хроническая персистирующая ПСЭ наблюдается редко, преимущественно у больных с выраженными портосистемными коллатералями, в том числе созданными в результате хирургического вмешательства. Помимо типичной психоневрологической симптоматики, наблюдаются постепенно проявляющиеся симптомы миелопатии: атаксия, хореоатетоз, параплегия, колющие или сверлящие боли. Нарушения обычно необратимы и ведут к церебральной атрофии и деменции. Клинические стадии Определение стадии ПЭ имеет важное значение для оценки прогноза пациента, так как этот критерий входит в наиболее надежную систему определения тяжести цирроза – функциональную классификацию Чайлд–Пью. Как уже отмечалось, стадии ПЭ, в сущности, являются степенями тяжести ввиду их потенциальной обратимости. Симптомы, характеризующие ПЭ 0–IV стадии, суммированы в таблице 5. Достаточно характерен для ПЭ II–III стадии т.н. хлопающий тремор или астериксис, проявляющийся быстрыми сгибательными и разгибательными движениями в лучезапястных суставах. ПЭ также сопровождается изменениями ЭЭГ, которые становятся явными на II стадии: уплощение кривой a–ритма, затем появление t– и d–активности. При ПЭ 0–I стадии ЭЭГ–диагностика осуществляется с использованием зрительных вызванных потенциалов. Для оценки состояния сознания больного с ПЭ, в том числе в динамике на фоне терапии, может также применяться шкала Глазго (табл. 6). Сумма баллов определяет сознание пациента от ясного (15 баллов) до атонической комы (3 балла). Прогноз ПЭ – один из важнейших факторов, определяющих прогноз заболевания печени. При ПСЭ, развивающейся у больных циррозом, прогностическое значение оценить труднее, чем при фульминантной печеночной недостаточности, в первую очередь вследствие влияния многочисленных дополнительных факторов. Однако в литературе имеются статистические сведения, позволяющие приблизительно определить ближайший прогноз больного с ПСЭ. При ПЭ 0–I стадии в текущую госпитализацию выживаемость приближается к 100%, прогрессивно ухудшаясь с углублением стадии энцефалопатии: при II стадии выживаемость составляет 60–75%, при III–IV – в среднем около 30%. 10–20% пациентов остаются в живых после первого эпизода печеночной комы. Прогноз также зависит от ряда дополнительных факторов. 1. Эндогенная печеночная кома (вследствие потери паренхимы печени) имеет худший прогноз по сравнению с экзогенной (вследствие сброса нейротоксинов кишечного происхождения по портосистемным шунтам). 2. Важнейшее значение принадлежит объему остаточной паренхимы печени (косвенно определяется по выраженности печеночной недостаточности). 3. На прогноз могут влиять этиология поражения печени и выраженность коллатерального кровообращения. 4. Вероятность неблагоприятного исхода выше в пожилом возрасте и при наличии сопутствующих заболеваний. 5. Следует учитывать возможность и скорость элиминации триггерных факторов; в первую очередь это относится к остановке желудочно–кишечного кровотечения. 6. Существенно улучшает прогноз своевременно начатое адекватное лечение ПЭ. Лечение Базисные мероприятия 1. Элиминация этиологического фактора заболевания печени – в тех случаях, когда это возможно (например, в случае алкогольного цирроза). При циррозах вирусной этиологии назначение a–интерферона нередко вызывает усиление ПЭ, что ограничивает его применение. Однако при циррозе в исходе HBV–инфекции может с успехом применяться нуклеотидный аналог ламивудин, подавляющий активность вируса и, как следствие, улучшающий функциональное состояние печени. 2. Элиминация триггерных и отягощающих факторов ПЭ: остановка кровотечения, коррекция гиповолемии, поддержание кислотно–щелочного и электролитного баланса, ликвидация инфекции и т.д. 3. Санация кишечника. Очищение толстой кишки преследует цель удаления азотсодержащих субстанций, особенно важного в случаях желудочно–кишечного кровотечения, пищевой перегрузки белком и запора. Эффективно применение высоких клизм, позволяющих очистить толстую кишку на максимальном протяжении, вплоть до слепой. Это может быть достигнуто путем перемены положения тела пациента: введение раствора начинают в положении больного на левом боку, затем продолжают в позиции на спине с приподнятым тазом и завершают в положении на правом боку. Общий объем вводимого раствора должен быть не менее 1000 мл дважды в день. В качестве растворов применяются натриево–ацетатный буфер (рН 4,5) или лактулоза (300 мл на 700 мл воды). Пероральные слабительные при выраженной ПЭ лучше вводить через назогастральный зонд. Инфузия 1000 мл 10%–ного раствора маннитола в течение 60–90 минут, вызывая осмотическую диарею, обеспечивает практически полную элиминацию кишечного содержимого на протяжении последующих 3–4 часов. В случае желудочно–кишечного кровотечения маннитол следует вводить через зонд до выделения чистого раствора из прямой кишки. Помимо маннитола, могут применяться 20–30%–ный сульфат магния (50–100 мл), а также комплексный раствор, состоящий из гидрокарбоната натрия, хлорида натрия, хлорида калия, сульфата натрия и полиэтиленгликоля. 4. Диета. У больных с любой стадией ПЭ целесообразно ограничение поступления белка с пищей. При латентной ПЭ белок рекомендуется ограничить приблизительно до 40 г/сут (0,6 г/кг массы тела), на I–II стадии – до 30 г/сут (0,4 г/кг). На III–IV стадиях оптимален перевод пациента на зондовое и парентеральное питание с содержанием белка около 20 г/сут. Белок в рационе больного ПЭ должен быть представлен преимущественно протеинами растительного происхождения и лактальбумином ввиду их лучшей переносимости. Растительные белки более богаты орнитином и аргинином и содержат меньше метионина и ароматических аминокислот. В отдельных случаях из рациона должны быть полностью исключены мясо, рыба, яйца и сыры. В то же время длительное и резкое ограничение белка способствует распаду эндогенных протеинов, что ведет к повышению концентрации азотсодержащих соединений в крови, поэтому поступление пищевого белка после улучшения состояния следует увеличивать в среднем на 10 г в 3 дня. После ликвидации признаков ПЭ (в том числе по результатам психометрических тестов) суточное количество белка может быть доведено до 80–100 г/сут (1–1,5 г/кг). Необходимо учитывать, что у каждого больного циррозом свой порог переносимости пищевого белка, и при белковой интолерантности его дефицит нужно восполнять парентеральными инфузиями. Калорийность пищи (1800–2500 ккал/сут) обеспечивается адекватным поступлением жиров (70–140 г) и углеводов (280–325 г). Углеводы способствуют уменьшению концентрации аммиака и триптофана в плазме, однако следует помнить, что больным циррозом свойственно развитие нарушения толерантности к глюкозе, что иногда требует назначения инсулина. Применение фруктозы, сорбитола и ксилитола нецелесообразно вследствие повышенного риска лактат–ацидоза. Пища больного циррозом должна также содержать адекватные количества витаминов и микроэлементов; при нарушении всасывания жирорастворимых витаминов показано их парентеральное введение. Медикаментозная терапия Лактулоза. Представляя собой невсасывающийся дисахарид (1,4–b–галактозид–фруктоза), лактулоза снижает внутрикишечный рН, препятствует размножению бактерий–аммониепродуцентов, всасыванию аммиака и аминосодержащих соединений, расщеплению глутамина в слизистой кишке. Лактулоза назначается 2–3 раза в сутки, дозировка препарата индивидуальна; в качестве простого, но надежного критерия эффективности рассматривается увеличение частоты стула до 2–3 раз в сутки. Наступление этого эффекта отражает снижение рН толстой кишки < 6,0. Побочные эффекты лактулозы включают тошноту, рвоту, потерю аппетита, вздутие живота, диарею и тенезмы. Длительная диарея может приводить к дегидратации и электролитному дисбалансу, поэтому при подборе дозы следует придерживаться правила, относящегося к частоте стула: «не реже чем два, не чаще чем три». Некоторые пациенты плохо переносят лактулозу из–за ее сладкого вкуса; для улучшения вкусовых качеств рекомендуется добавление лимонного сока. Промежуточные метаболиты цикла мочевины. К этой группе относятся L–орнитин–L–аспартат, L–орнитин–a–кетоглутарат и аргинин–малат. Получивший наибольшее распространение L–орнитин–L–аспартат выпускается как в виде раствора для внутривенной инфузии, так и в форме гранулята для перорального приема. Механизмы действия препарата основываются на: 1) стимуляции ферментов, участвующих в детоксикации аммиака – орнитин–карбамоил–трансферазы и глутаминсинтетазы; 2) включении орнитина и аспартата в качестве субстратов в орнитиновый цикл мочевинообразования Кребса (образование мочевины из аммиака). Стандартная схема применения предусматривает внутривенное капельное введение 20–30 г препарата в течение 7–14 дней с последующим переходом на пероральный прием 9–18 г в сутки. При длительном применении (6–месячный курс по 9 г в сутки перорально) препарат эффективно предотвращает рецидивы ПЭ. Бензоат и фенилацетат натрия с успехом используются для лечения пациентов с врожденными дефектами ферментов орнитинового цикла. Способность препаратов к связыванию аммиака в крови служит основанием для его применения у больных ПЭ, однако эффект их непродолжителен. Аминокислоты с разветвленной цепью (АКРЦ). Хотя аминокислотный дисбаланс рассматривается в качестве одного из патогенетических факторов ПЭ, корреляции между соотношением ароматических аминокислот и АКРЦ, с одной стороны, и выраженностью ПЭ, с другой, не обнаружено. Вероятно, положительный клинический эффект инфузий АКРЦ обусловлен уменьшением белкового катаболизма в печени и мышцах, а также улучшением обменных процессов в головном мозге. Следует учитывать, что АКРЦ являются важным источником белка для больных с ПЭ, которым требуется ограничение пищевого белка. Рекомендуемая дозировка – 0,3 г/кг/сут. Антибиотики назначаются с целью подавления аммониепродуцирующей кишечной микрофлоры. Неомицин (доза 6–8 г/сут) и паромоцицин (3–4 г/сут) в настоящее время применяются редко ввиду их ото– и нефротоксичности. В последние годы предпочтение отдается более безопасному рифаксимину (суточная доза 1200 мг, длительность курса 1–2 недели). К другим антибиотикам, применяемым у больных ПЭ, относятся ципрофлоксацин, метронидазол и рифаксимин. Рассматривая возможность назначения антибиотиков больным с ПЭ, важно учитывать не только их побочное действие, но и соотношение стоимость/эффективность. Можно констатировать, что терапевтическая ниша антибиотиков при ПЭ представлена двумя группами пациентов: нуждающимися в усилении действия лактулозы; не переносящими стандартную терапию. Флумазенил – антагонист бензодиазепиновых рецепторов – назначается внутривенно струйно в дозе 0,2–0,3 мг, затем капельно 5 мг/ч. После улучшения состояния больного осуществляется переход на пероральный прием в дозе 50 мг/сут. Эффективность препарата выше, если причиной манифестации ПЭ явился прием барбитуратов или бензодиазепинов.
Литература 1. Ивашкин В.Т., Надинская М.Ю., Буеверов А.О. Печеночная энцефалопатия и методы ее метаболической коррекции. Бол. орг. пищевар. 2001; 3: 25–7. 2. Лебезев В.М., Губский Л.В. Печеночная энцефалопатия при хирургическом лечении больных с портальной гипертензией. Клин. мед. 1995; 73: 37–9. 3. Conn H.O., Bircher J. (eds.). Hepatic encephalopathy: syndromes and therapies. Bloomington, Illinois: Medi–Ed Press 1994: 243 p. 4. Hepatic encephalopathy. In: Kuntz E., Kuntz H.–D. Hepatology. Principles and practice. Springer 2002: 234–54. 5. Plauth M., Egberts E.–H. Was ist gesichert in der therapie der hepatischen enzephalopathie? Internist 1993; 34: 35–42. 6. Stauch S., Kircheis G., Adler G. et al. Oral L–ornithine–L–aspartate therapy of chronic hepatic encephalopathy: results of placebo–controlled double–blind study. J. Hepatol. 1998; 28: 856–64.