Повернуть время вспять: новые рубежи в терапии рассеянного склероза
– Рассеянный склероз – довольно распространенное неврологическое заболевание во всем мире. Какова ситуация в России?
– Я бы не сказала, что мы каким-то образом отличаемся от всего мира, у нас примерно такой же возрастной диапазон пациентов. По заболеваемости мы относимся к зоне среднего риска, у нас от 10 до 50 случаев на 100 тысяч населения, но в разных регионах ситуация немного отличается. Официальная актуальная статистика, к сожалению, известна только Министерству здравоохранения РФ, но на недавнем заседании Совета Федерации представители ведомства сообщили, что в федеральном регистре у нас уже более 85 тысяч пациентов. Хотя в медицинском сообществе предполагают, что больных должно быть больше 100 тысяч человек.
– Как классифицируется профильная пациентская аудитория?
– Принято выделять три типа течения рассеянного склероза: ремиттирующее, вторично-прогрессирующее и первично-прогрессирующее. У 70–85% пациентов заболевание дебютирует с ремиттирующего течения, которое впоследствии переходит во вторично-прогрессирующее. Примерно 10–15% – это пациенты с первично-прогрессирующим течением. Официальной статистики по первично-прогрессирующему течению в России пока нет, потому что для этих пациентов до 2021 года не было таргетной терапии. Поэтому, как правило, их доля оказывалась заниженной, где-то 2–5% официально наблюдавшихся. Сейчас, поскольку появилась таргетная терапия, изменился подход и к ведению регистра, и к диагностике. Мы стремимся к более ранней диагностике и большему учету этих пациентов, потому что сейчас появились решения, которые мы можем им предложить в качестве терапии. Соответственно, постепенно мы точно приблизимся к выявлению 10% пациентов с первично-прогрессирующей формой и будем примерно так и отражать эту группу статистически. Если брать всех больных с разделением по долям, трудно однозначно сказать, но, наверное, примерно 70% будет ремиттирующих, 20% вторично-прогрессирующих и около 10% первично-прогрессирующих пациентов.
– А каковы сценарии развития заболевания?
– У пациентов с ремиттирующим течением самый благоприятный сценарий, потому что у них заболевание протекает с обострениями и ремиссиями. Соответственно, во время обострения появляются какие-то новые симптомы. Часть из них или все могут регрессировать, а могут оставлять за собой неврологический дефицит. Но в период ремиссии считается, что состояние пациента стабильное, то есть нет нарастания симптоматики и прироста инвалидизации. Если частота обострений будет высокой или они в принципе будут сохраняться, то, конечно, этот пациент может в какой-то момент приобрести признаки инвалидности. У вторично-прогрессирующего типа, сменяющего ремиттирующую фазу болезни, заболевание прогрессирует не с самого начала. Это как раз пациент, который изначально имел волнообразное течение болезни, а затем начал демонстрировать признаки неуклонного нарастания неврологического дефицита и, соответственно, усугубления инвалидизации. При этом у него могут сохраняться обострения, но прогрессирование от них не зависит. У некоторых пациентов обострения на этом этапе болезни уже отсутствуют и наблюдается только нарастание инвалидизации. При первично-прогрессирующем типе считается, что сразу, с самого дебюта, идет неуклонное нарастание неврологического дефицита. То есть симптоматика не регрессирует, а только присоединяются новые проявления болезни.
– Каковы сейчас подходы к терапии пациентов с ремиттирующим рассеянным склерозом?
– Терапевтические подходы остаются неизменными. У нас есть патогенетическая терапия, а есть симптоматическая. К патогенетической относят гормонотерапию при обострениях и иммуномодулирующую терапию, направленную на предупреждение обострений, задержку прогрессирования и нарастания изменений в ткани мозга. Для пациентов с ремиттирующим течением рассеянного склероза линейка препаратов самая широкая. Практически каждый год выходит какой-то новый препарат, который добавляет возможности для лечения. Тактически среди всех пациентов с ремиттирующим течением стали выделять пациентов с быстропрогрессирующим сценарием и с высокоактивным рассеянным склерозом. Это те пациенты, у которых либо каждое обострение оставляет неврологический дефицит, и таким образом состояние больного с каждым новым обострением утяжеляется, либо те, кто в принципе в течение года, несмотря на получение какой-либо терапии, испытывают два и более обострений, то есть их трудно удержать просто в состоянии ремиссии. При наблюдении таких пациентов используют более агрессивную стратегию: либо ранняя эскалация терапии – их переводят с первой линии на вторую, либо доктор сразу имеет право начать лечение препаратами второй линии.
– С какого момента пациентам с рассеянным склерозом назначают лекарственную терапию?
– Вообще, мировая практика, равно как и российская, такова – как только пациенту диагностировали рассеянный склероз, врачи ориентируют на раннее начало терапии. В нашей стране после установления диагноза персонифицированные сведения о пациенте вносятся в федеральный регистр Министерства здравоохранения РФ, и пациент приобретает право получать лекарственную терапию бесплатно. Другое дело, что не все пациенты соглашаются на лечение, которое проводится годами, некоторые предпочитают, чтобы за ними наблюдали, прежде чем начать принимать лекарственные препараты. В любом случае мы стараемся всем подбирать оптимальный вариант терапии.
– Как тогда определяют эффективность назначенного препарата?
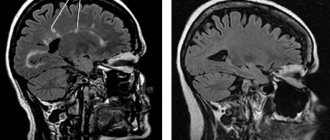
– Тут используются три критерия: во-первых, клиническое наблюдение – сохраняются или отсутствуют обострения; во-вторых, неврологический осмотр с оценкой состояния по международной шкале инвалидизации EDSS – есть или нет нарастания неврологического дефицита; и в-третьих, МРТ головного/спинного мозга в динамике позволяет оценить активность процесса в виде появления новых очагов или контрастируемых очагов.
– Учитывая появление новых препаратов, изменяются ли ожидания врачей от терапии?
– Конечно, нам хочется, чтобы помимо влияния на количественные изменения мозговой ткани, появлялась бы еще и возможность тормозить атрофию головного мозга, скорость которой у наших пациентов выше, чем возрастная физиологическая атрофия. Это одно из новых требований. И второе – это возможность влиять на нейродегенерацию. Иными словами, было бы идеально, если бы появилась возможность уменьшать стойкий неврологический дефицит и поворачивать процесс вспять. Но пока препаратов, способных удовлетворить этим ожиданиям, нет.
– Работаете ли вы с препаратом алемтузумаб (Лемтрада®) и как оцениваете практику его применения?
– У меня большой опыт применения этого препарата, я знакома с ним с этапа разработки и наблюдаю пациентов на терапии с 2003 года в рамках клинических исследований. У меня довольно хорошие впечатления, хотя, могу сразу сказать, что алемтузумаб – непростой препарат, поэтому он показан не всем больным по профилю безопасности.
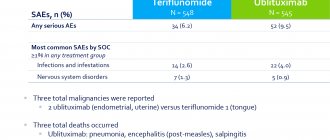
По последним данным клинических исследований препарата, а сейчас доступны девятилетние данные, у 49% пациентов, участвовавших в клиническом исследовании CARE-MS II, было достигнуто улучшение, и оно сохранялось на протяжении этого времени. Максимальный период наблюдения за моими пациентами, получавшими терапию алемтузумабом, составил 15 лет, но это исследование уже завершено, и препарат уже зарегистрирован. Несмотря на это, компания-разработчик продолжает собирать данные как в отношении эффективности, так и профиля безопасности в процессе проведения III фазы клинических исследований. Терапия алемтузумабом отличается от других иммуномодулирующих препаратов цикловым режимом дозирования. Первый лечебный курс терапии состоит из двух лечебных циклов с интервалом в год. В моей когорте пациентов есть те, которые, получив эти два лечебных цикла, больше не нуждались в повторном введении препарата на протяжении всего периода наблюдения в рамках исследования. А есть пациенты, у которых в одних случаях три года спустя, в других – пять или шесть лет, все равно был «всплеск» активности заболевания. Им проводили еще один лечебный цикл и благодаря этому поддерживающему циклу удавалось удержать пациента в стабильном состоянии. Поэтому нельзя сказать, что 100% пациентов были стабильны по итогам первого стартового цикла. Но по данным клинических исследований, проводимых компанией-разработчиком, примерно 55% наблюдаемых действительно не нуждались в повторном введении препарата и при этом сохраняли стабильное состояние. То есть получили два лечебных цикла и дальше все у них было хорошо.
– Для какой группы пациентов рекомендован препарат?
– Сейчас у препарата обновлена инструкция, где четко определен профиль пациентов. Это пациенты с сохраняющейся активностью заболевания на фоне иммуномодулирующей терапии первой линии (высокоактивное течение заболевания) либо пациенты с быстропрогрессирующим рассеянным склерозом, у которых, как я уже говорила, наблюдается два и более обострений, ведущих к нарастанию неврологического дефицита. Таких больных в принципе по мировой статистике 15–20% от всех пациентов с ремиттирующим типом заболевания. Это таргетная популяция пациентов для такого вида терапии.
– Один из новых критериев эффективности препарата – подтвержденное уменьшение инвалидизации (CDI). Какие актуальные данные есть у медицинского сообщества по этому показателю?
– Естественно, мы, врачи, мечтаем о снижении инвалидизации. Данные исследований алемтузумаба говорят о том, что такой результат получить возможно. Но мы должны понимать, что этот эффект уменьшения инвалидизации достижим не у всех пациентов. Наверное, можно получить этот результат, и он будет стойким, если правильно определен профиль пациента и самое главное – своевременно начата терапия. Повернуть время вспять вероятно возможно, если терапия начата в первые три – пять лет от дебюта заболевания.
– Когда и как оценивается подтвержденное уменьшение инвалидизации?
– Оценка проводится по расширенной шкале инвалидизации EDSS. Уровень инвалидизации соответствует определенному баллу, который может увеличиваться или уменьшаться. Чем выше балл, тем больше уровень нетрудоспособности пациента. После неврологического осмотра врач может оценить уровень EDSS и отметить, есть ли его увеличение, что говорит нам о прогрессировании заболевании, либо уменьшение, свидетельствующее об улучшении состояния пациента. Представьте, у вас есть какие-то симптомы, а затем их выраженность уменьшилась, либо они регрессировали, их нет.
– Препарат Лемтрада® (МНН алемтузумаб) в 2021 году включили в перечень 14 высокозатратных нозологий, как это решение оценено медицинским сообществом?
– Конечно, позитивно. Это дает возможность обеспечивать препаратом столько пациентов, скольким показана эта терапия. Потребность в препарате каждый субъект РФ определяет сам. Раньше доступность этой терапии ограничивалась финансовыми возможностями субъекта, теперь эти препараты централизованно приобретает Минздрав.
Материал подготовлен при поддержке представительства АО «Санофи-Авентис Груп» (Франция)
MAT-RU-2001393
Крик о помощи
Защитные полумеры: из аптек и стационаров пропадает иммуноглобулин
Пациенты из разных регионов жалуются, что не могут получить жизненно необходимый препарат
В Московском обществе рассеянного склероза (МосОРС) бьют тревогу: препарат метилпреднизолон («Метипред», «Медрол», «Солу-Медрол»), дефицит которого ощущался с осени, теперь почти совсем пропал.
— В наступившем году это уже не системный дефицит и перебои в поставках. Остатки препарата закончились, его просто нет, — рассказала «Известиям» президент МосОРС Ольга Матвиевская.
По ее словам, препарат в столице отсутствует и в аптеках, и в стационарах.
Пациентам, среди которых ее муж Андрей, он необходим для купирования обострений. Кроме того, метилпреднизолон необходим для подготовки больных к дорогостоящей терапии, входящей в программу 14 высокозатратных нозологий. Пропажа метилпреднизолона означает срыв терапии, которая стоит более миллиона рублей в год на одного пациента.
Москва — не единственный город, в котором пропал препарат. Также его нет, в частности, в Ярославле, выяснили «Известия».
Без укола
Фото: ИЗВЕСТИЯ/Дмитрий Коротаев
— В стационаре лекарства нет. Применяем дексаметазон или используем таблетированную форму метилпреднизолона. Альтернативная терапия сопровождается большим риском развития нежелательных явлений: образованием язвы желудка, повышением давления, сахара в крови, а также появлением сыпи, — рассказал председатель ярославской областной общественной организации инвалидов — больных рассеянным склерозом «Гефест», врач-невролог Игорь Степанов.
«Известия» попросили депздравы Москвы и Ярославской области разъяснить ситуацию. Ответа из Ярославля не поступило, а в столичном департаменте заявили, что дефицит метилпреднизолона действительно фиксируется в некоторых коммерческих сетях аптек на территории Москвы. Но городские стационары обеспечены препаратом в полном объеме.
Таблетки несчастья: Матвиенко призвала не закупать медикаменты впрок
Лекарственного коллапса позволит избежать ужесточение правил продаж, считают политики
Новая клеточная иммунотерапия для лечения рассеянного склероза
Лечение нацелено на вирус Эпштейна-Барра (ВЭБ) и основано на теории, сформулированной профессором Майклом Пендером(Michael Pender). В 2003 году профессор Пендер предположил, что РС возникает из-за накопления ВЭБ-инфицированных клеток в головном мозге и что терапия, нацеленная на вирус, может остановить прогрессирование заболевания.
Клеточная иммунотерапия была разработана профессором Радживом Кханной(Rajiv Khanna) и его командой, а клиническое испытание фазы I было проведено в сотрудничестве с профессором Пендером и его коллегами.
Профессор Пендер сказал, что 10 пациентов – пять со вторично прогрессирующим рассеянным склерозом РС и пять с первичной прогрессирующей РС – получили новое лечение клеточной иммунотерапией в количестве четырех доз.
Результаты оказались успешными – семь из этих пациентов показали улучшения.
При этом улучшения варьировались от снижения усталости и повышения производительности и качества жизни до улучшения зрения и мобильности. Новое лечение рассеянного склероза было безопасным и не показало никаких серьезных побочных эффектов.
Таким образом, на основании результатов нового исследования, ученые предполагают, что инфекция вирусом Эпштейна-Барра действительно играет определенную роль в развитии РС. Ученые отметили, что иммунотерапия Т-клетками была использована для лечения аутоиммунного заболевания впервые, хотя она уже используется для лечения различных типов рака и вирусных инфекций.
Этот прорыв в лечении рассеянного склероза открывает возможности для поиска применения подобных клеточных иммунотерапий также при некоторых других аутоиммунных заболеваниях.
Фаза I клинических испытаний началась в ноябре 2015 года. Исследование фазы II, спонсируемое Atara Biotherapeutics, планируется в нескольких местах в Австралии и Соединенных Штатах.
Рассеянный склероз, который является заболеванием центральной нервной системы, приводит к развитию таких симптомов, как проблемы с координацией, нарушение баланса, слабость конечностей, когнитивное ослабление и потеря памяти.
У большинства пациентов с РС диагностирована рецидивирующая форма, но некоторые из них развивают вторичную прогрессивную форму, в которой неврологический дефицит постепенно ухудшается. С самого начала лишь небольшая часть диагностируется с первичной прогрессивной формой. Доступен целый ряд методов лечения, направленных на предотвращение атак в рецидивирующем РС, но существуют ограниченные варианты лечения для людей с прогрессивными формами рассеянного склероза.
Клеточная иммунотерапия включает в себя прием крови у пациентов, извлечение T (иммунных) клеток и «обучение» их в лаборатории для распознавания и уничтожения ВЭБ при поражении головного мозга пациентов с РС. Клеточные иммунотерапии были изготовлены в QIMR Berghofer’s Q-Gen Cell Therapeutics, одном из крупнейших производственных центров по производству клеток в Австралии.
Результаты клинических испытаний использования клеток для лечения РС опубликованы в JCI Insight.