Статья на конкурс «био/мол/текст»: Сейчас сложно найти человека, который никогда не слышал про болезни Альцгеймера, Паркинсона или Хантингтона. Эти недуги относятся к группе нейродегенеративных заболеваний, вызывающих гибель нейронов и постепенное разрушение головного мозга. К сожалению, все они являются неизлечимыми. Поэтому ученые активно работают над тем, чтобы раскрыть механизмы развития этих болезней и найти терапию, которая поможет спасти пациентов. В своем исследовании мы обратились к пока еще малоизученному вопросу — что происходит с синаптической связью нейронов при нейродегенеративном процессе? Результаты этой работы открывают новое направление для разработки лекарства от болезни Хантингтона и других нейродегенеративных заболеваний.
Конкурс «био/мол/текст»-2013
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2013.
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
С увеличением средней продолжительности жизни все больше людей страдают от болезни Альцгеймера и болезни Паркинсона. К сожалению, годы исследований пока не привели ученых к открытию причин развития этих заболеваний и возможной терапии. Это связано, главным образом, с тем, что почти ничего не известно о факторах, вызывающих болезнь, а также с тем, что очень мало пациентов имеют генетическую предрасположенность. Чаще всего эти заболевания являются спорадическими, т.е. причины их возникновения не установлены. Это приводит к бесконечным спорам — никто не знает, как искусственно вызвать это заболевание у модельных животных для экспериментов и поиска лекарств. Поэтому все больше ученых обращают свое внимание на генетические заболевания нервной системы, такие как болезнь Хантингтона (БХ). Это заболевание также, как болезнь Альцгеймера и болезнь Паркинсона, относится к группе нейродегенеративных заболеваний, с которыми его объединяет ряд схожих черт: гибель нейронов центральной нервной системы, накопление амилоидоподобных агрегатов белков, когнитивные и двигательные нарушения у больных. При этом БХ имеет важное преимущество с точки зрения исследователей, т.к. известно, какая мутация вызывает это заболевание. Это дает возможность создавать точные генетические модели и исследовать их на животных. Это важно, потому что если мы поймем патогенез болезни Хантингтона, то нам легче будет разобраться и со спорадическими нейродегенеративными заболеваниями. Это мы и попытались сделать в своем исследовании.
Клиника лечения хореи Гентингтона
Лечение заболевания должно проводиться только под руководством и присмотром врачей психиатрической клиники. Генетически сложная болезнь в любое время может проявляться по-разному, поэтому важно не упустить момент начала появления симптомов. Клиника лечения хореи Гентингтона должна специализироваться на неврологических отклонениях у людей.
Медленно прогрессирующее заболевание нервной системы и коры головного мозга неизлечимо, но человек с таким диагнозом должен постоянно находиться под наблюдением специалиста, который сможет в экстренной ситуации правильно рассчитать и применить медицинский препарат. За больными людьми необходим бережный уход, а также присмотр таких врачей, как психиатры, неврологи, психологи, окулисты и ортопеды.
Болезнь Хантингтона
Болезнь Хантингтона (БХ, в русскоязычной литературе также «болезнь Гентингтона») — наследственное заболевание нервной системы, которое поражает примерно 1 из 10 тыс. людей. Болезнь была впервые описана Джорджем Хантингтоном (George Huntington) в 1872, и с тех пор носит его имя, однако клинические симптомы этого заболевания были известны еще в XVI веке под названием «хорея» (от лат. choreus — танец). К признакам хореи относили непроизвольные, нескоординированные быстрые движения, похожие на судороги; именно так описывают и современные медики моторные нарушения, характерные для БХ. Болезнь может порой длиться до двадцати лет, но исход неизменно один и тот же: больной теряет способность самостоятельно передвигаться, говорить, а затем и мыслить. Как правило, симптомы болезни Хантингтона проявляются в возрасте от 30 до 50 лет, хотя у 5–10% пациентов отмечается появление симптомов в возрасте до 20 лет — так называемая ювенильная форма заболевания [1].
Первый симптом болезни Хантингтона — непроизвольные подёргивания конечностей, торса и лицевых мышц. Довольно часто они сопровождаются резкими сменами настроения, депрессией, раздражительностью, неразборчивостью речи и неуклюжестью движений. По мере прогрессирования болезни, к этим симптомам добавляются затруднения или боль при глотании, неустойчивость походки, потеря равновесия, нарушение мыслительных функций и ухудшение памяти. В конце концов, больной теряет способность передвигаться без помощи посторонних и умирает обычно от пневмонии, остановки сердца или других осложнений.
Важной для врачей и исследователей особенностью БХ является то, что это заболевание является наследственным и вызывается мутацией в одном-единственном гене. Оказалось, что к развитию БХ приводит увеличение количества повторов триплета CAG, кодирующего глутамин, в первом экзоне гена белка хантингтина. При этом, чем больше количество повторов этого триплета, тем раньше начинается развитие заболевания. В норме в человеческой популяции встречается от 10 до 35 повторов. У пациентов с БХ количество повторов может быть от 36 до 121, при ювенильной форме — от 50 и выше [2]. Благодаря выявлению генетической основы заболевания, диагностика БХ в настоящее время не представляет проблемы; кроме того, возможной стала пренатальная диагностика заболевания и проверка эмбрионов перед имплантацией при ЭКО, которая позволяет иметь здоровых детей даже носителям мутантного гена.
К сожалению, выявление точной мутации все еще не позволяет ученым определить причину развития болезни Хантингтона и найти соответствующее лечение. Появление в клетке мутантного гена и, соответственно, измененного (мутантного) белка может привести к развитию патологии двумя путями: потеря функции (loss-of-function) или приобретение функции (gain-of-functin). В первом случае мутантный белок не может выполнять ту же функцию, что белок нормальный, и это приводит к нарушению клеточных процессов. Во втором случае, мутантный белок мешает нормальной жизнедеятельности клетки, начиная выполнять какую-то «лишнюю функцию». Чтобы разобраться, что происходит при БХ, ученые интенсивно изучают как функцию нормального белка хантингтина, так и поведение его мутантной формы [3].
К сожалению, попытки определить точную клеточную функцию хантингтина пока не увенчались успехом. Различные исследования указывают на участие этого белка в широком спектре биологических процессов, включая транспорт белков и везикул (мембранных пузырьков-транспортеров), организацию цитоскелета, клатрин-опосредованный эндоцитоз, постсинаптический сигналинг, регуляцию транскрипции и анти-апоптотические процессы [4]. Если удастся доказать, что нарушение какой-либо из этих функций является ключевым для развития заболевания, то лекарственные препараты для поддержания этой функции могут спасти пациентов с болезнью Хантингтона.
Если верна гипотеза о приобретении функции, особое внимание стоит обратить на поведение мутантной формы хантингтина. Оказалось, что мутантный белок формирует агрегаты, которые являются одной из характерных черт развития БХ как у людей,так и у модельных животных (см.врезку). Сначала агрегаты были описаны только в ядре, однако последующие работы выявили их также в цитоплазме и отростках нейронов [5]. В последние годы многие авторы склоняются к тому, что образование агрегатов несет скорее протективную функцию, а основной патогенной формой мутантного хантингтина является мономерный растворимый белок [6].
Профилактика хореи Гентингтона у взрослого в домашних условиях
– В настоящее время, – говорит врач-невролог Валентина Кузьмина, – применима реабилитация с использованием комплексной программы лечебных мероприятий с обучением родственников командой специалистов: врачом ЛФК, врачом физиотерапевтом, логопедом, клиническим психологом и врачом-неврологом.
Так как хорея Гентингтона – это наследственное заболевания, в качестве профилактики можно предложить проведение пренатальной диагностики или доимплантационного генетического тестирования эмбрионов (ПГТ-М), то есть, медико-генетическое консультирование семьи.
Модели для изучения болезни Хантингтона
Модели БХ на животных появились более 30 лет назад. Первыми были модели, основанные на введении в стриатум нейротоксических веществ (например, хинолиновой кислоты — агониста NMDA-рецепторов), которые вызывали гибель нейронов. В настоящее время большинство исследователей работает на моделях трансгенных животных, среди которых есть не только мыши и крысы, но и беспозвоночные животные — мушка Drosophila melanogaster и червь Caenorhabditis elegans.
Мышиные модели болезни Хантингтона отличаются друг от друга количеством CAG-повторов и уровнем экспрессии трансгена — искусственно внесенного гена хантингтина. Т.к. именно от этих факторов зависит развитие БХ, разные линии мышей отличаются друг от друга скоростью развития патологий. К наиболее широко используемым моделям относят линии мышей R6/2, R6/1 и YAC128, которые были использованы и в нашей работе. У мышей этих линий симптомы заболевания наиболее выражены и проявляются достаточно быстро. Кроме того, у этих животных с возрастом прогрессируют когнитивные и моторные нарушения, развивается частичная потеря нейронов в стриатуме и коре.
Еще одним из способов моделирования БХ является использование клеточной культуры. В самом простом случае используются культуры клеток со стабильной трансфекцией гена хантингтина. Например, это клетки линии PC12, содержащие индуцибельный трансген первого экзона хантингтина или нейроны стриатума с экспрессией фрагментов хантингтина разной длины. Кроме того, можно использовать первичные культуры из нейронов трансгенных мышей или иммортализованные нейроны.
Причины
Генетические аспекты. Увеличение числа повторов CAG — триплетов гена хантингтина (143100, ген HD, IT15, 4p16–3, Â). Передача гена по отцовской линии, а также увеличение числа повторов приводят к более тяжёлой форме заболевания, раннему началу и быстрому прогрессированию.
Патогенез. Прогрессирующая гибель нервных клеток. Выраженное снижение содержания нейромедиаторов (g — аминомасляной кислоты, глутаматдекарбоксилазы, вещества P, энкефалинов) в базальных ганглиях. Выраженное снижение активности дыхательной цепи митохондрий в хвостатом ядре.
Патоморфология. Макроскопически: атрофия хвостатого ядра и расширение желудочков. Микроскопически: глиоз и гибель нейронов, особенно в хвостатом ядре и скорлупе.
Почему мы решили исследовать параметры синаптической передачи при болезни Хантингтона
Синаптическая передача — это передача сигналов между нейронами с помощью синаптического контакта. При возбуждении одного нейрона его синаптическое окончание выделяет в синаптическую щель медиатор — химическое вещество, которое оказывает свое возбуждающее или тормозящее воздействие на синаптическое окончание второго нейрона (рис. 1). Таким образом, синапсы связывают нейроны между собой, обеспечивая нормальное функционирование нейронных сетей и всей нервной системы. Если какая-то из систем головного мозга перестает функционировать, причина может крыться либо в нарушении работы отдельных нейронов, либо в нарушении связи между ними, т.е. нарушении синаптической передачи.
Рисунок 1. Схематическое изображение устройства синапса.
«Википедия»
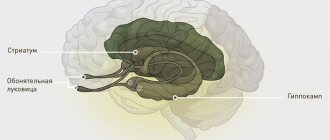
При болезни Хантингона поражается специфическая область головного мозга, называемая стриатумом. Стриатум является частью важного нейронного пути — экстрапирамидной системы, которая участвует в управлении движением и поддержании мышечного тонуса. Гибель нейронов стриатума при болезни Хантингтона приводит к разрушению экстрапирамидной системы, что связано с потерей контроля над движениями у больного человека. Но когда возникают первые патологические симптомы (тремор, нарушение координации), головной мозг человека еще не поврежден: нейроны начинают погибать только через несколько лет после начала развития заболевания. Т.е. болезнь начинается, когда что-то меняется в работе самих нейронов или в синаптической передаче, и эти нарушения впоследствии ведут к гибели нейронов и необратимым последствиям.
Накопившиеся за последние годы результаты исследований заставляют многих ученых склоняться к мысли, что именно нарушение нормальной работы системы нейрональной связи, синапсов и синаптической передачи, приводит к ранним нарушениям в работе экстрапирамидной системы. Оказалось, что в нейронах с мутациями в гене, кодирующем белок хантингтин, наблюдается целый ряд патологических изменений, которые нарушают синаптическую передачу. В таких мутантных клетках нарушается формирование и обновление запаса везикул (пузырьков с медиатором), изменяется внутриклеточная концентрация кальция , который необходим для нормального высвобождения медиатора в синаптическую щель, снижается количество ряда необходимых для функционирования синапса белков и т.п. [7]. Все это приводит к сниженному выбросу медиатора в синаптическую щель, а если медиатора недостаточно, то нейроны начинают хуже «слышать» друг друга, и команды, посылаемые корой головного мозга, не будут выполняться по всей строгости.
В 2013 году Нобелевской премии по физиологии и медицине удостоены работы, благодаря которым стали ясны детали везикулярного транспорта — процесса образования и транспортировки мембранных пузырьков (везикул) между клетками: «Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт» [8]. — Ред.
Изучение нарушенной синаптической передачи при БХ было темой нашего исследования. Может ли быть, что неправильная работа нейронов стриатума на ранней стадии БХ вызвана тем, что они «не слышат» команды нейронов коры? Может ли ослабление синаптической связи приводить к необратимым изменениям в нейронах стриатума и вести к их гибели? О чем мы узнали во время поиска ответов на эти вопросы, рассказано ниже.
Медико-социальная экспертиза
Определение
Хорея Гентингтона (ХГ) — прогрессирующее наследственное дегенеративное заболевание, основными клиническими признаками которого являются хореический гиперкинез, деменция и прогрессирующее течение. Распространенность в разных странах колеблется от 3,2 до 17,4 на 100 000 населения. Значение заболевания определяется и ранней социальной дезадаптацией больных. Подавляющее большинство из них признаются инвалидами II или I группы. Этиология и патогенез ХГ относится к болезням экспансий, возникающих вследствие динамических мутаций. Сущность мутации заключается в экспансии (повторении) одних и тех же тринуклеотидных последовательностей. Появление мутаций в гене увеличивает способность к его дальнейшему мутированию, что определяет феномен антиципации — более раннее начало и более тяжелое течение болезни у потомков. Ген ХГ картирован на коротком плече 4-й хромосомы. Он содержит область ДНК, в которой нуклеотидная последовательность представлена увеличенным количеством триплетов, свидетельствующим об экспансии. Патоморфологическим субстратом болезни является атрофия подкорковых экстрапирамидных ганглиев и коры мозга. Вес подкорковых ядер уменьшается на 50 %, вес всего мозга — на 25 %. Преимущественно атрофируются мелкие клетки скорлупы и хвостатого ядра (холинергические и ГАМКергические нейроны). В коре головного мозга отмечается атрофия мелких клеток, клетки Беца не поражаются. Выявляется также дегенерация ГАМКерги- ческого стрионигрального тракта. Предполагается, что уменьшение ацетилхолиновых и ГАМК-нейронов ведет к нарушению баланса нейромедиаторов в сторону преобладания дофаминовой медиации. Лечение препаратами, увеличивающими в мозгу содержание ГАМК (например, препаратами вальпроевой кислоты), не дает эффекта, а L-ДОФА усиливает гиперкинез. В то же время лечение антагонистами дофамина отчетливо уменьшает выраженность гиперкинеза, поэтому галоперидол и другие нейролептики нашли широкое применение. Клиника и критерии диагностики Болезнь наследуется аутосомно-доминантно, с высокой экспрессивностью и пенетрантностью. В связи с поздней клинической манифестацией ХГ при ранней смерти родителей может создаваться впечатление о спорадических случаях. Средний возраст появления первых симптомов болезни — 38 лет, средняя продолжительность болезни — 13—15 лет, а жизни — 52 года. Однако в 10% случаев заболевание начинается в возрасте около 18 лет, а иногда и раньше — так называемый юношеский, акинетико-ригидный вариант. Как правило, первые симптомы ХГ — суетливость, излишняя подвижность, рассеянность. В начале заболевания гиперкинезы возникают эпизодически по типу пароксизмов, ограничиваясь определенной группой мышц, чаще мимических. Основной тип гиперкинеза — хореический, напоминает внезапно возникшие выразительные движения, жестикуляцию, гримасничание, подергивание носом, всхрапывание, вздохи. По мере прогрессирования болезни нарастает тонический компонент, атетоидный оттенок движений, затем хореоатетоз. Расстройство речи проявляется в дизартрии, лишних звуках. Мышечный тонус низкий или нормальный. Иногда бывают вегетативные нарушения, гипоталамические симптомы (булимия, полидипсия). Рефлексы, чувствительность не страдают. При акинетико-ригидной форме патологический доминантный ген передается от отца. Клинически проявляется акинетико- ригидным синдромом, сочетающимся с легким ограниченным хореическим гиперкинезом и нарастающим слабоумием. Прогрессирование более быстрое, прогноз хуже, чем при классическом варианте. Второй симптом ХГ — нарушения психики. Параллелизма между степенью психического дефекта и выраженностью гиперкинеза нет, хотя он обычно возникает раньше. Психические расстройства проявляются нарушением аффективной сферы, параноидно-галлюцинаторными психозами с яркими зрительными, тактильными, слуховыми галлюцинациями, бредовыми идеями. В преморбиде психические отклонения отмечаются у 30—60 % больных еще до появления гиперкинеза (интеллектуально-мне- стическое снижение, психопатоподобное поведение, социальная неполноценность). Наиболее характерен психоорганический синдром, на поздних этапах болезни достигающий степени деменции. Деменция при ХГ отличается относительно медленной прогреди- ентностью, вследствие чего больные поздно госпитализируются, сохраняя трудоспособность в рамках простой привычной деятельности. В конечной стадии ХГ может наблюдаться ослабление или исчезновение гиперкинеза с нарастанием скованности, повышением мышечного тонуса. Критерии диагностики: — аутосомно-доминантное наследование; — средний или пожилой возраст начала болезни (при акинетико-ригидном варианте начало возможно в детском, юношеском возрасте); — прогрессирующий хореический гиперкинез; — прогрессирующие психические нарушения. Данные дополнительных исследований: 1) результаты молекулярно-генетического исследования методом прямой ДНК-диагностики (Иванова-Смоленская И. А., 1995, 1996); 2) данные медико-генетического консультирования; 3) ЭЭГ — выявляется низковольтная биоэлектрическая активность, иногда на ранней стадии заболевания; 4) экспериментально-психологическое исследование (состояние интеллектуально-мнестических функций). Характерна деменция подкоркового типа; 5) КТ, МРТ — атрофия коры, изменение конфигурации передних рогов боковых желудочков вследствие атрофии хвостатого ядра; 6) ПЭТ — снижение метаболизма глюкозы в хвостатом ядре (даже на ранней стадии болезни); 7) консультация психиатра. Дифференциальный диагноз 1. С хореей беременных (обычно рецидив перенесенной в детстве малой хореи). 2. С хореическим синдромом, вызванным L-ДОФА, иногда контрацептивами. 3. С гепато-церебральной дистрофией. 4. Акинетико-ригидная форма — с паркинсонизмом. 5. С истерическим гиперкинезом. Течение и прогноз Клинический и социальный прогноз во всех случаях неблагоприятны — болезнь неуклонно прогрессирует. Нарастание тяжести ХГ и появление первых симптомов в более молодом возрасте от поколения к поколению может быть использовано при оценке реабилитационного потенциала. Больные обычно умирают от интеркуррентных заболеваний. Принципы лечения Наиболее оправдавшим себя направлением в лечении ХГ является подавление дофаминергической передачи. Кроме резерпина, который блокирует дофамин в пресинаптических депо, применяют фенотиазины (аминазин) и бутирофеноны (галоперидол, триседил), ингибирующие постсинаптические дофаминовые рецепторы. Применение этих препаратов, прежде всего галоперидола, позволяет добиться временного улучшения и задержки прогрессирования заболевания у многих больных. В связи с необходимостью длительного приема и возможными осложнениями, дозы должны быть умеренными: аминазина не более 150 мг в сутки, галоперидола не более 15 мг в сутки. При акинетико-ригидной форме ХГ применяют с некоторым успехом препараты L-ДОФА, парлодел (бромокриптин). В качестве дополнительных средств при терапии ХГ используют ноотропы, церебролизин. Могут возникнуть показания для госпитализации больных ХГ в психиатрический стационар (при острых психотических расстройствах) или в специализированный психоинтернат в связи с выраженной социальной дезадаптацией. Медико-социальная экспертиза Критерии ВУТ Основание для ВН — стационарное обследование с целью уточнения диагноза, разработки схемы лечения (около 1 месяца). При декомпенсации, отчетливом прогрессировании заболевания временно нетрудоспособны работающие больные (обычно с последующим направлением на БМСЭ). Характеристика ограничения жизнедеятельности 1. Двигательные нарушения. Целесообразно выделять 4 степени выраженности гиперкинеза при ХГ, который наряду с психическим дефектом определяет состояние жизнедеятельности и трудовые возможности больных: 1) Легко выраженный гиперкинез. Насильственные движения возникают только при выполнении сложных тонких движений, иногда объективизация возможна при нагрузочных тестах. Походка не нарушена, больной справляется с прежней работой, полностью обслуживает себя. Легкий локальный гиперкинез может также выявляться при усталости вследствие большой физической нагрузки, значительном эмоциональном напряжении. 2) Умеренный гиперкинез. Отчетливо заметны небольшой амплитуды, как правило, локальные, насильственные движения (в лице, в руке, при ходьбе). Наблюдаются во время движения, при многих обычных действиях. В случае волнения, физической усталости они могут переходить на другие группы мышц, но никогда не принимают характера двигательной бури. Эффективны корригирующие приемы. Передвижение свободное, но при тестах (ходьба по заданной прямой, с закрытыми глазами) обнаруживаются выраженные ограничения. То же можно отметить при письме, срисовывании. Могут быть умеренные изменения речи. Самообслуживание сохранено, хотя в целом жизнедеятельность ограничена (больные испытывают некоторые трудности при сложных манипуляциях с замками, бытовой техникой, недостаточно качественно и быстро выполняют свои домашние обязанности). 3) Выраженный гиперкинез. Насильственные движения возникают преимущественно во время движения, но, распространенные, периодически наблюдаются и в покое, временами (особенно в случае волнения) достигают степени двигательной бури. Четко выражена «танцующая походка», значительны нарушения артикуляции (речь мало понятна), невозможно письмо. В быту больные нуждаются в посторонней помощи, так как значительно снижаются ловкость, способность владеть телом, возможность коммуникации. Бытовое самообслуживание (одевание, личный туалет, еда), хотя недостаточно качественное, сохраняется. 4) Резко выраженный гиперкинез. Постоянные распространенные (генерализованные) хореические и хореоатетозные насильственные движения часто возникают и в покое. Ходьба невозможна, речь абсолютно непонятна. В быту больной нуждается в постоянной посторонней помощи во всех действиях (в том числе в личной гигиене, еде, одевании). 2. Психические нарушения могут значительно ограничивать жизнедеятельность, в том числе на ранней стадии заболевания. Снижается способность к контролю за ситуацией, поведением. При деменции, психозах невозможна ориентировка, в связи с чем больные неспособны к самообслуживанию, нуждаются в постоянной помощи, надзоре. Показания для направления на БМСЭ 1. Фактически все больные с диагностированной ХГ (через 1—4 года от начала заболевания в зависимости от характера трудовой деятельности). Противопоказания к продолжению прежней работы весьма обширны из-за гиперкинеза, почти всегда сочетающегося с психическим дефектом. Фактически только лица, выполняющие несложный и подсобный труд, могут оставаться на прежней работе, да и то со значительным уменьшением ее объема. 2. Больные с выраженным и резко выраженным гиперкинезом и психическими нарушениями. Необходимый минимум обследования при направлении на БМСЭ 1. Данные медико-генетического анализа. 2. Экспериментально-психологическое исследование. 3. Осмотр психиатра. 4. Рентгенография черепа. 5. ЭЭГ. 6. Общие анализы крови, мочи. Критерии инвалидности Основными критериями МСЭ при ХГ являются распространенность и выраженность гиперкинеза, выраженность психических расстройств, темп прогрессирования, социальные факторы. III группа: умеренное ограничение жизнедеятельности вследствие легкого (умеренного) гиперкинеза и психических нарушений (по критерию ограничения способности к трудовой деятельности первой степени). II группа: значительное ограничение жизнедеятельности при прогрессировании заболевания, выраженном распространенном гиперкинезе, отчетливых психических нарушениях (по критериям ограничения способности к самообслуживанию, передвижению, контролю за своим поведением второй степени). I группа: выраженный гиперкинез, исход болезни в экстрапи- рамидную ригидность, деменция, приводящие к резко выраженному нарушению жизнедеятельности (по критериям ограничения способности к передвижению, общению, контролю за своим поведением, самообслуживанию третьей степени). При условии наблюдения за инвалидами I и II группы в течение 5 лет она определяется бессрочно. Причина инвалидности — как правило, общее заболевание. Профилактика инвалидности 1. Первичная профилактика: пренатальная диагностика (возможна в первом триместре беременности). 2. Вторичная профилактика: а) своевременная диагностика, диспансерное наблюдение, постоянная патогенетическая терапия; б) в случае доклинической диагностики (тестирования на ген ХГ) — профессиональная переориентация, приобретение профессии с учетом возможных противопоказаний. 3. Третичная профилактика: а) предупреждение срывов компенсации у работающих больных; б) своевременное определение инвалидности в зависимости от степени ограничения жизнедеятельности; в) осуществление других мер социальной помощи. Реабилитация Индивидуальная программа реабилитации составляется для больных с относительно медленным прогрессированием заболевания. 1. Медицинская реабилитация: регулярная патогенетическая медикаментозная терапия. 2. Профессиональная реабилитация: а) трудоустройство инвалидов III группы на несложных, лучше привычных работах (раздача инструментов, упаковка и сортировка в индивидуальном темпе, уборка помещения, работа в небольшом гардеробе и т. п.); б) некоторые инвалиды II группы могут быть трудоустроены на дому, больные с преобладанием психических нарушений трудоустраиваются в лечебно-трудовых мастерских.
3. Социальная реабилитация: а) снабжение средствами передвижения (велоколяска, кресло-коляска), техническими средствами ухода за больным; б) психологическая помощь семье больного, обучение уходу за тяжелым больным ХГ.
Источник
Результаты исследований: изменения в синаптической передаче при болезни Хантингтона
Изучать синаптическую передачу можно различными способами. Например, это можно делать, проникнув в нейронную цепочку с помощью методов электрофизиологии. Нейрон проявляет свою активность с помощью электрического тока, который можно измерить. Если экспериментатор возьмет цепочку из двух нейронов и, активировав один нейрон, зарегистрирует электрическую активность второго, он сможет выяснить, насколько хорошо проходит сигнал. Другой способ изучать функционирование синаптической передачи — исследовать морфологию нейрона. Дело в том, что многие нейроны (в том числе, нейроны коры и стриатума) имеют особые выросты мембраны — шипики, которые нужны им именно для образования синапсов (рис. 2). Чем более активно нейрон «общается» со своими соседями, тем больше на его поверхности шипиков. Взяв на вооружение эти два подхода, мы решили исследовать, как работает синаптическая передача при БХ.
Рисунок 2. Дендритные шипики на поверхности стриатного нейрона. Шипики — небольшие выросты на поверхности нейрональных отростков; на увеличенном изображении они отмечены стрелками.
фото автора статьи
Рисунок 3. Нейрональная культура из нейронов коры и стриатума. С помощью специфических антител нейроны коры окрашены в красный цвет, а нейроны стриатума — в желто-зеленый.
фото автора статьи
В качестве модели для изучения болезни Хантингтона была использована клеточная культура из нейронов коры и стриатума. Для приготовления культуры незрелые нейроны из изучаемых зон мозга мышей высаживаются в чашки Петри, где они формируют полноценные нейрональные отростки и нейронные цепочки (рис. 3). Использовались мыши дикого типа (без мутаций) и мыши линии YAC128, которые несут мутацию в гене белка хантингтина и являются признанной моделью БХ. На 14–15 день после высаживания нейронов в чашку Петри они достигают зрелого состояния, соответствующего состоянию нейронов в мозге взрослого человека, а на 19–20 день нейроны считаются «старыми»: в них наблюдается ряд клеточных процессов, характерных для мозга пожилых людей. Кроме того, с возрастом в нейронах мышей YAC128 происходит накопление мутантного белка хантингтина и его агрегатов, поэтому изучение нейрональной культуры на этих двух этапах дает представление о том, что происходи в мозге пациента с БХ на ранней и на поздней стадиях заболевания.
Рисунок 4. Шипики разных типов на поверхности дендрита — микрофотография и схематическое изображение.
Для начала мы исследовали морфологические отличия между двумя линиями, т.е. сравнили их внешний вид. Для нормальных нейронов стриатума характерно наличие большого количества шипиков, благодаря чему их называют средними шипиковыми нейронами (СШН). Именно шипики формируют большую часть синаптических контактов между нейронами стриатума и коры, и для осуществления нормальной синаптической передачи важно наличие определенного их количества. Так же важно и «качество» шипиков: в современной нейробиологии их разделяют на три группы согласно размеру и форме (рис. 4): грибовидные, тонкие и пеньковые. При этом шипики разных типов выполняют разные функции: считается, что только грибовидные шипики формируют активные синапсы, в то время как тонкие и пеньковые контактов с другими нейронами не образуют. Таким образом, для нормального функционирования нейронной цепочки и эффективной передачи информации по ней необходимо наличие определенного количества грибовидных шипиков.
Для того, чтобы узнать, сколько грибовидных шипиков должно быть на СШН в норме, на всех этапах морфологического анализа как контроль использовалась культура нейронов из головного мозга мышей дикого типа. Оказалось, что количество шипиков на СШН стриатума на 14 день культивирования (молодые нейроны) одинаково в культурах YAC128 и дикого типа, но на 20 день (у «старых» нейронов) наблюдаются значительные изменения (рис. 5). В «постаревшей» культуре YAC128 снижается общее количество шипиков, причем относительное количество грибовидных шипиков, которые образуют активные синапсы, уменьшается в два раза [10]. Получается, что морфологические изменения нейронов, свидетельствующие о нарушении синаптической передачи, развиваются только к «старости» (на поздней стадии заболевания). Значит, на ранних этапах корень проблемы должен лежать в другой области.
Рисунок 5. Морфологический анализ нейронов стриатума. а — шипики нейронов на 14 и 20 дни культивирования. На микрофотографиях показаны участки дендритов нейронов. Относительное количество шипиков разных типов отмечено на круговой диаграмме: зеленый — грибовидные шипики, красный — тонкие шпики, черный — тонкие шипики. На 20 день культивирования на поверхности нейронов YAC128 снижается доля грибовидых шипиков и возрастает доля пеньковых. б — Плотность дендритных шипиков (среднее количество шипиков на участке дендрита длиной 10 мкм) на нейронах дикого типа и YAC28.
Поэтому мы сравнили электрофизиологические характеристики двух линий. Это возможно благодаря электрической активности нейронов, которую можно зарегистрировать с помощью специального метода, называемого пэтч-кламп. Для этого к поверхности нейрона прикладывают тонкую стеклянную пипетку, внутри которой находится электрод. Когда нейрон активируется, на его клеточной мембране изменяется напряжение, и это изменение регистрируется электродом. Если взять два связанных синаптическим контактом нейрона и, возбуждая один, регистрировать ответную электрическую активацию на втором, можно измерить эффективность передачи сигнала через синапс (рис. 6). Если ответная активация возникает не всегда, то, вероятно, синаптическая передача ослаблена. Этот метод может выявить нарушения работы синапса до изменений морфологии нейрона.
Рисунок 6. Схема эксперимента при совместном применении оптогенетики и электрофизиологической регистрации. Нейрон коры активируется при освещении синим светом, а на контактирующем с ним нейроне стриатума производится регистрация ответной активности с помощью стеклянной пипетки с электродом.
Чтобы активировать нейрон, можно использовать несколько способов. Можно добавить в окружающую его жидкость химическое вещество, открывающее ионные каналы, что приводит к электрическому возбуждению нейрона. Можно стимулировать нейрон электрическим током. Но мы для своих экспериментов выбрали более тонкий инструмент воздействия на нейроны, а именно — оптогенетику. Этот подход основан на внесении в нейроны специальных светочувствительных белков — опсинов, в результате чего и сами нейроны становятся чувствительными к свету (рис. 7). В результате, освещая нейроны светом определенной длины волны, можно изменять их активность. Освещение синим светом возбуждает нейрон, а желтым — вызывает торможение (т.е. подавляет активность нейрона).
Оптогенетические технологии в наши дни обещают даже вернуть зрение людям с дегенеративными поражениями сетчатки, придав световую чувствительность не разрушенным фоторецепторам, а клеткам-ганглиям: «Оптогенетика + голография = прозрение?» [11]. — Ред.
Рисунок 7. Опсины — светочувствительные белки, обеспечивающие движение ионов через клеточную мембрану и изменение активности нейронов. Каналородопсин (ChR2) вызывает деполяризацию мембраны и активацию нейрона, галородопсин (NpHR) вызывает гиперполяризацию мембраны и торможение нейрона.
Генетическое обследование на болезнь Гентингтона в гене HTT
Увеличение числа CAG-триплетных повторов (экспансия) в 1 экзоне гена HTT является причиной развития болезни Гентингтона, аутосомно-доминантного неврологического заболевания.
Синонимы русские
Хорея Гентингтона, экспансия триплетных повторов, ген HTT, генетическое обследование.
Синонимы английские
Huntington disease, expansion of CAG (cytosine-adenine-guanine) triplet repeats, HTT gene.
Название гена
Ген HTT.
Локализация гена на хромосоме
Локус 4p16.
Метод исследования
Фрагментный анализ 1 экзона гена HTT.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Болезнь Гентингтона (БГ) – наследственное прогрессирующее нейродегенеративное заболевание, вызванное экспансией CAG-триплетных повторов в 1 экзоне гена HTT, располагающегося на коротком плече 4 хромосомы и кодирующего белок гентингтин (HTT). Небольшое количество нуклеотидов CAG (цитозин-аденин-гуанин) в гене HTT встречается в норме, однако при увеличении числа повторов (экспансии) более 35 вероятность развития заболевания и передачи гена потомкам значительно увеличивается. Размер экспансии коррелирует с тяжестью симптоматики и временем первых проявлений заболевания.
Встречаемость заболевания среди населения с европейскими корнями составляет 10:100000. Заболевание наследуется по аутосомно-доминантному типу, то есть имеется 50% риска его развития у потомков.
Болезнь Гентингтона проявляется преимущественно неврологической симптоматикой. Клинические проявления и признаки:
- Моторные нарушения — гиперкинезы: хорея, дистония, атетоз, тремор, миоклония; окуломоторные нарушения; брадикинезия и ригидность; дисфагия; нарушение равновесия, координации и походки.
- Когнитивные нарушения — снижение исполнительных повседневных функций; деменция.
- Нейропсихические нарушения — депрессия; раздражительность, агрессивность; психозы (бред, галлюцинации, паранойя, сверхценные идеи); апатия; персеверация и обсессивно-компульсивное расстройство.
- Инструментальное обследование — МРТ головного мозга: атрофия головки хвостатого ядра, проявляющаяся увеличением фронтальных рогов латеральных желудочков головного мозга. Уменьшение объема коры головного мозга. При МР-спектроскопии: увеличение лактата в области затылочной коры; уменьшение индекса NAA/creatine. При исследовании ПЭТ/КТ: гипометаболизм базальных ганглиев и фронтальной коры.
Для чего используется исследование?
В соответствии с международными клиническими рекомендациями, генетическое обследование на болезнь Гентингтона проводится при наличии у пациента клинической симптоматики, характерной для данного заболевания, а также родственникам и детям больного.
Когда назначается исследование?
- При подозрении на болезнь Гентингтона;
- при дифференциальной диагностике гиперкинезов;
- при дифференциальной диагностике хореи и дистонии;
- при когнитивных и нейропсихических нарушениях;
- при выявлении характерных изменений при проведении МРТ-исследования головного мозга;
- при раннем выявлении заболевания у родственников;
- при планировании семьи.
Что означают результаты?
Генетическое обследование является основным методом подтверждения диагноза и основано на подсчете числа тройных CAG-повторов с помощью метода фрагментного анализа в гене НТТ. Диагностическая значимость обнаруженного числа CAG-повторов в гене HTТ представлена в таблице:
| Количество CAG-повторов в гене HTT | Диагностический тест | Прогностический тест | Риск развития для детей |
| 6-26 – нормальная аллель | Болезнь Гентингтона исключена | Болезнь Гентингтона не разовьется | Невысокий риск развития болезни Гентингтона |
| 27-35 – умеренное увеличение | Болезнь Гентингтона очень маловероятна | Маловероятно, что болезнь Гентингтона разовьется | Риск развития БГ ( |
| 36-39 – умеренная экспансия | Диагноз «болезнь Гентингтона» подтвержден. Возможна легкая форма проявлений | Может развиться болезнь Гентингтона со сниженной пенетрантностью | Повышенный риск развития болезни Гентингтона |
| 40 и более – выраженная экспансия | Диагноз «болезнь Гентингтона» подтвержден | Болезнь Гентингтона разовьется | Повышенный риск развития болезни Гентингтона |
Что может влиять на результат?
Хотя генетический тест является точным методом лабораторной диагностики, время клинических проявлений заболевания (пенетрантность болезни) зависит от внешней среды, индивидуальных генетических факторов. Для оценки характера наследования у детей и родственников, риска прогрессирования заболевания и назначения лечения рекомендуется получить консультацию специалиста.
Важные замечания
- Для получения заключения по результату обследования необходимо проконсультироваться у клинического генетика.
Кто назначает исследование?
Невролог, психиатр, врач-генетик.
Также рекомендуется
[42-054] Генетическое обследование на гентингтоноподобное заболевание 2 типа в гене JPH3
[42-055] Генетическое обследование на гентингтоноподобное заболевание 4 типа в гене TBP
[42-056] Генетическое обследование на дентаторубро-паллидолюисову атрофию в гене ATN1
[42-057] Комплексное обследование на гентингтоноподобные заболевания (ГПЗ2,ГПЗ4,ДРПЛА)
[06-080] Церулоплазмин
[06-083] Медь в крови
[06-136] Медь в моче
[42-048] Обследования на частые генетические причины мозжечковой атаксии (СЦА 1,2,3,6,7, АФ)
[42-043] Определение экспансии триплетов при спиноцеребеллярной атаксии 1 типа (в гене ATXN1)
[42-044] Определение экспансии триплетов при спиноцеребеллярной атаксии 2 типа (в гене ATXN2)
[42-045] Определение экспансии триплетов при спиноцеребеллярной атаксии 3 типа (в гене ATXN3)
[42-046] Определение экспансии триплетов при спиноцеребеллярной атаксии 6 типа (в гене CACNA1A)
[42-047] Определение экспансии триплетов при спиноцеребеллярной атаксии 7 типа (в гене ATXN7)
[13-060] Диагностика системной красной волчанки
Литература
- Martha Nance et al., A Physician’s Guide to the Management of Huntington’s disease (Third Edition), HDSA 2011.
- Robert B. Daroff, Bradley’s Neurology in Clinical Practice, 2-Volume Set, 7th Edition,Elsevier, 2021.
- Losekoot M, van Belzen MJ, Seneca S, Bauer P, Stenhouse SaR, Barton DE. EMQN/CMGS best practice guidelines for the molecular genetic testing of Huntington disease. Eur J Hum Ge net. 2013; 21(5): 480-486.
- Bean L, Bayrak-Toydemir P. American College of Medical Genetics and Genomics Standards and Guidelines for Clinical Genetics Laboratories, 2014 edition: technical standards and guidelines for Huntington disease. Genet Med. 2014; 16(12): e2.
Оптогенетика
Оптогенетика — метод, объединяющий подходы генетики и оптики для тонкого контроля электрической активности электровозбудимых клеток (нейронов и мышечных волокон) [9]. Для этого в изучаемые клетки вводят гены специальных светочувствительных белков — микробных опсинов, которые являются ионными каналами или насосами (рис. 7). Первая работа, показавшая возможность управлять электрической активностью нейронов при использовании опсина, была опубликована в 2005 году. За последующие несколько лет появился еще ряд экспериментальных работ, позволивших доработать эту методику и доказать ее применимость в различных экспериментальных условиях.
За последние годы было открыто множество различных опсинов, из которых наибольшее применение в оптогенетике нашли галородопсины и каналородопсины. При доставке гена опсина с помощью методов генной инженерии в нейрон, на плазматической мембране появляются светочувствительные каналы, а сама клетка становится светочувствительной. При действии синего света открывается пора каналородопсина (максимум поглощения — 470 нм), который вызывает движение положительно заряженных ионов внутрь клетки, обеспечивая деполяризацию мембраны нейрона и генерацию потенциалов действия. При действии желтого света активируется галородопсин (максимум поглощения — 580 нм), мембрана нейрона гиперполяризуется, вызывая торможение нейрона. Высокое временное разрешение метода оптогенетики позволяет обеспечить очень тонкую регуляцию синаптических событий и является, таким образом, важным инструментом для изучения межнейронных связей.
Совместное применение оптогенетики и классических методов электрофизиологии позволяет извлечь выгоду из положительных качеств каждого из этих подходов. Точность электрофизиологической регистрации объединяется с возможностью использовать световые стимулы разной длительности и интенсивности, что помогает ученым подробно изучать работу нейронных связей.
Электрическая активность нейронов выражается в резких скачках напряжения на клеточной мембране и появлении вследствие этого электрического тока. Эти резкие скачки называются спайками или потенциалами действия и длятся несколько миллисекунд (рис. 8). Мы выяснили, что чем дольше нейрон освещается синим светом, тем больше спайков он за это время создает. Если освещаемый нейрон связан синаптическим контактом с другим нейроном, то на втором нейроне можно зарегистрировать ответную активность — тоже в виде отдельных спайков.
Рисунок 8. Пример записи, получаемой при электрофизологической регистрации активности нейрона. Спайки (потенциалы действия) отражаются на записи в виде вертикальных линий, показывающих резкие скачки мембранного тока.
В наших экспериментах мы использовали пару молодых (14 дней) нейронов коры и стриатума, связанных синаптическим контактом. Нейрон коры активировали синим светом, а на нейроне стриатума производили регистрацию ответной активности. Оказалось, что для возникновения ответа на нейроне стриатума нужна определенная длительность освещения (порог активации). Если длительность освещения была ниже порогового значения, то спайк на нейроне стриатума возникал в ответ не на каждую вспышку света. И что самое важное: порог активации для нейронов из мозга здоровых мышей отличался от мышей YAC128 (с мутацией в гене хантингтина). Наиболее ярко эта разница была видна при 50%-активации нейрона стриатума, т.е. длительности освещения, при которой спайк возникает в ответ на каждую вторую вспышку света. Порог 50%-активации нейрона стриатума в ответ на облучение кортикального нейрона для культуры клеток YAC 128 был примерно в два раза (точнее в 2,3±0,8) выше по сравнению с положительным контролем [10].
Получается, что мутация в белке хантингтине приводит к тому, что синаптическая передача ухудшается уже в молодых нейронах, и при этом нарушения происходят на функциональном уровне (без морфологических изменений). Может ли быть так, что именно эти функциональные нарушения в дальнейшем приводят к появлению морфологических изменений, таких как исчезновение шипиков у старых нейронов стриатума?
Чтобы ответить на этот вопрос, мы снова обратились за помощью к оптогенетике, но теперь с ее помощью мы подавляли светом активность нейронов (рис. 9а). Если наше предположение верно, то временное отсутствие активирующего воздействия коры должно привести к исчезновению шипиков на нейронах стриатума в культуре YAC128. Действительно, после эксперимента количество шипиков в положительном контроле осталось неизменным, но в культуре YAC128 значительно снизилось (рис. 9б, в). Получается, что моделирующие БХ нейроны особенно чувствительны к ослаблению активирующего воздействия нейронов коры, поэтому длительное ослабление синаптической связи между этими нейронами приводит к уменьшению количества шипиков на 20 день культивирования [10].
Рисунок 9. Влияние на нейроны с помощью оптогенетики. а — подавление активности нейрона коры с помощью оптогенетики. При освещении нейрона желтым светом (оранжевая полоса) он становится неактивен — на электрофизиологической записи в этот промежуток времени почти нет спайков. б — влияние длительного оптогенетического торможения на морфологию нейронов. На микрофотографиях видно уменьшение количества шипиков на дендрите нейрона YAC128. в — изменение плотности дендритных шипиков после оптогенетического торможения. В культуре дикого типа количество шипиков не изменяется, а в культуре YAC128 плотность шипиков значительно снижается.
Таким образом, мы обнаружили, что в нашей модели БХ наблюдается нарушение синаптической передачи, которое развивается в два этапа. На ранней стадии (молодые нейроны, на 14 день культивирования нейронов) происходит функциональное ослабление сипаптической связи, которое на более поздней стадии (старые нейроны, на 20 день культивирования) приводит к морфологическим нарушениям синаптических контактов.
Вывод: нарушение синаптической передачи и нейродегенеративные заболевания
Исследование подтвердило нашу первоначальную догадку: нарушение работы стриатума при БХ связано, прежде всего, с нарушением синаптической передачи. Нейроны стриатума перестают «слышать» команды нейронов коры, и, в результате, человек начинает терять контроль над своими движениями. Но на ранней стадии заболевания эти нарушения носят функциональный характер и, вероятно, обратимы. Если выяснить причины, ведущие к нарушению работы синапсов, то возможно разработать лекарственное средство, которое поможет остановить патологические изменения, обеспечит нейронам стриатума необходимый уровень активации и, таким образом, предотвратит развитие необратимых морфологических нарушений.
Результаты этой работы подталкивают и к другому важному заключению: при изучении нейродегенеративных заболеваний ученым следует обратить больше внимания на синаптическую передачу и взаимодействие нейронов. Мы знаем достаточно много о том, как влияет накопление амилоидных агрегатов при болезни Альцгеймера на жизнедеятельность клетки, и какие нейроны погибают при развитии болезни Паркинсона, но это все еще не привело к появлению эффективной терапии. Возможная причина этих неудач — мы не учитываем последствия нарушения синаптических связей — те, которые мы открыли при исследовании болезни Хантингтона. Хочется надеяться, что наши находки подскажут исследователям направление для разработки эффективных способов лечения болезни Хантингтона, и Тринадцатая наконец-то будет здоровой!
Исследование было проведено в лаборатории молекулярной нейродегенерации СПбГПУ (зав. лаб. — проф. Техасского университета Илья Борисович Безпрозванный) под руководством к.б.н. Дмитрия Николаевича Артамонова.