Рассеянный склероз: безопасное переключение с финголимода на алемтузумаб
Переключение с «Гилении» (Gilenya, финголимод) на «Лемтраду» (Lemtrada, алемтузумаб) в ходе лечения рецидивирующего рассеянного склероза — после короткого «отмывочного» периода (когда никакая терапия не применяется, дабы вывести из организма предыдущий препарат) — не приводит, как установлено, к росту риска реактивации заболевания. Более того, алемтузумаб, продвигаемый «Санофи» (Sanofi), обеспечивает существенное ослабление воспалительного процесса, отражающееся уменьшением числа рецидивов и новых областей поражения головного мозга, — если сравнивать с применением финголимода, за которым стоит «Новартис» (Novartis).
Ранее было отмечено, что переход от «Гилении» к «Лемтраде» в ряде случаев вызывает существенную и неожиданную активизацию рассеянного склероза ввиду недостаточности ответа на алемтузумаб. Предполагаемая причина кроется в относительно коротком времени полувыведения последнего, когда он попросту не успевает истощить пул циркулирующих аутореактивных лимфоцитов, которые всё еще секвестированы в лимфоидной ткани. Последующий выход лимфоцитов, «укрывшихся» от благотворных биологических эффектов алемтузумаба, провоцирует реактивацию болезни. Этот феномен нуждается в дальнейшем изучении в целях углубления понимания методологии индивидуализированного подхода к разработке схем лечения рассеянного склероза.
Финголимод (fingolimod) является модулятором сфингозин-1-фосфатных рецепторов (S1PR), причем неспецифичным: он связывается с их подтипами 1, 3, 4 и 5 (S1PR1, S1PR3, S1PR4 и S1PR5). Финголимод, связываясь и стимулируя S1Р-рецепторы на поверхности лимфоцитов, работает как функциональный антагонист. Результатом становится интернализация и деградация искомых рецепторов с соответствующим снижением их активности. Поскольку экспрессия S1Р-рецепторов позволяет лимфоцитам следовать по градиенту последних, чтобы покинуть лимфоидные органы, финголимод блокирует подобную активность, изолируя (секвестируя) лимфоциты в пределах лимфоидной ткани. Итогом становится препятствование миграции лимфоцитов с последующей инфильтрацией центральной нервной системы, что обеспечивает противовоспалительный эффект за счет мощного снижения концентрации циркулирующих T-хелперов 17 (Th17) и продуцируемого ими эффекторного цитокина интерлейкина 17 (IL-17).
Алемтузумаб (alemtuzumab) связывается с белком CD52, имеющимся на поверхности B- и T-лимфоцитов, а также естественных киллеров, моноцитов и макрофагов, что приводит к лизису лимфоцитов, опосредованному антителозависимым клеточным цитотоксическим эффектом и фиксацией комплемента.
Исследование, выполненное специалистами из Университета Кальяри (Италия), поставило задачу раскрыть проблему: действительно ли переключение с финголимода на алемтузумаб ассоциировано с повышенным риском реактивации рассеянного склероза либо же указанную реактивацию следует ожидать в ходе изменения схемы лечения, осуществленного ввиду неэффективности финголимода.
Анализ охватил данные 77 пациентов с рецидивирующим рассеянным склерозом, которые перешли на «Лемтраду», отказавшись от «Гилении», после того как он перестал действовать. Средний возраст участников составил 36,2 лет; на долю женщин пришлось 79,2%; заболевание в среднем длилось 12,3 лет. Период «отмывки» между двумя препаратами равнялся в среднем 1,8 месяца. Свыше половины больных (64%) получили более одного курса терапии «Лемтрадой». До назначения алемтузумаба у большей половины (55%) пациентов был отмечен нормальный уровень лимфоцитов в крови (>1000 клеток/мл) — у остальных их число было ниже нормы.
«Мосмедпрепараты»
Частота рецидивов в пересчете на год (ARR) во время лечения «Гиленией» составляла 0,60. В «отмывочный» период она выросла до 1,33. После начала применения «Лемтрады» показатель ARR упал до 0,20.
После смены препарата 14% пациентов (n=11/77) столкнулись с одним и более рецидивами. Медиана времени до первого рецидива в «отмывочном» периоде составляла 28 дней, после назначения «Лемтрады» она существенно выросла — до 315 дней.
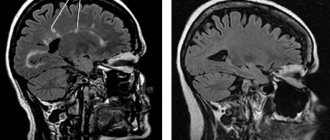
В процессе приема финголимода новые области поражения головного мозга и новые активные поражения, снятые на T2- и T1-взвешенных МРТ-изображениях соответственно, были зафиксированы у 69,2% и 58,6% пациентов. После переключения на алемтузумаб указанные пропорции резко снизились до 10,4% и 2,2%.
Подводя итоги, исследователи отметили отсутствие высокой активности рассеянного склероза в первый год лечения «Лемтрадой», назначенного после «Гилении», притом что алемтузумаб обеспечил серьезное сдерживание воспалительного процесса в сравнении с финголимодом. Это справедливо, даже в случае равно как короткого по длительного «отмывочного» периода, так и нормального числа лимфоцитов, которые, как известно, напрямую участвуют в патофизиологии рассеянного склероза. Таким образом, применение «Лемтрады» вскоре после отказа от «Гилении» не является фактором риска для реактивации болезни. Заявлено, что оптимально переключаться с одного препарата на другой необходимо где-то после месяца паузы, чтобы число лимфоцитов не оказалось слишком низким.
Рассеянный склероз
Алемтузумаб способен восстанавливать поврежденные ткани головного мозга?
22 октября 2008 г. – В проведенном исследовании экспериментальный препарат против рассеянного склероза показал себя намного более эффективным, чем общепринятые методы лечения рассеянного склероза. Но все хорошее имеет свою цену.
У пациентов с рецидивирующе-ремитирующим рассеянный склероз, получавших лечение алемтузумабом, наблюдалось меньшее количество обострений, а также признаков прогрессирования рассеянного склероза, чем у получающих стандартное на сегодняшний день лечение препаратами интерферона бета-1а.
Примечательно, что у некоторых из пациентов, получавших экспериментальный препарат, спустя три года после начала исследования степень инвалидизации, связанной с это болезнью, была даже меньшей, чем в его начале. Это дает основания надеяться, что данное лечение даст возможность останавливать развитие болезни прежде, чем она успеет привести к тяжелым инвалидизирующим последствиям.
Один из испытуемых умер
Однако почти у каждого четвертого испытуемого, получавшего алемтузумаб, развивались связанные с этим лечением нарушения функции щитовидной железы.
Еще большую тревогу вызвал тот факт, что у 3% лечившихся им возникло опасное для жизни аутоиммунное заболевание, которое в одном из случаев привело к смерти.
Один из руководителей исследования доктор Аласдер Коулз сообщил, что на ближайшее время планируется III стадия клинических испытаний препарата, в задачи которой входит выяснить, превосходит ли потенциальная польза от алемтузумаба в лечении пациентов с рецидивирующе-ремитирующим рассеянным склерозом риск от его побочных действий.
По данным американского общества рассеянного склероза, рецидивирующе-ремитирующий рассеянный склероз составляет около 85% всех случаев вновь выявленного рассеянного склероза.
Отчет о результатах исследования опубликован в журнале «The New England Journal of Medicine» от 23 октября.
«Итоги II стадии испытаний впечатляют, однако препарат еще не готов к использованию в широкой клинической практике, — говорит д-р Коулз. – Нам нужно узнать больше о его эффективности и побочных эффектах, возникающих при длительном приеме. Это работа еще на несколько лет».
Лечиться раз в год
Разработанный несколько десятилетий назад учеными кембриджского университета алемтузумаб был первым из препаратов моноклональных антител для применения у людей. Он официально разрешен к применению в лечении хронического лимфолейкоза (ХЛЛ).
Действие алемтузумаба основано на обнаружении и разрушении определенного вида иммунных клеток, которые в норме служат для защиты организма от инфекций. Считается, что при рассеянном склерозе и других аутоиммунных заболеваниях функционирование этих клеток нарушается, что приводит к разрушению здоровых тканей.
Первоначально кембриджские исследователи испытывали действие препарата на пациентах с поздними стадиями рассеянного склероза, однако успех этих испытаний был весьма скромным.
Во II стадии испытаний, результаты которой стали известны лишь недавно, участвовали только пациенты с ранними стадиями рецидивирующе-ремитирующего рассеянного склероза, не получавшие ранее других препаратов, используемых в лечении рассеянного склероза.
В период с декабря 2002 г. по июль 2004 для участия в исследовании были отобраны 334 пациента из Европы и США.
Около 1/3 пациентов получали стандартную терапию интерфероном бета-1а, который вводился в виде инъекций трижды в неделю. Остальных лечили с помощью алемтузумаба, назначаемого в виде цикла внутривенных инфузий, который проводили раз в год.
Первый цикл включал четырехчасовые инфузии препарата ежедневно на протяжении пяти дней. Через двенадцать месяцев большинство пациентов получили второй цикл лечения, состоявший из трех инфузий на протяжении трех дней.
Эффективность была беспрецедентной
Через три года после начала исследования лечение экспериментальным препаратом четко ассоциировалось с резким уменьшением количества клинически выраженных рецидивов заболевания, а также снижением активности воспалительного процесса (что подтверждалось данными МРТ мозга) в сравнении с интерфероновой терапией.
Однако наиболее впечатляющим результатом исследования Коулз считает то, что экспериментальное лечение позволило обратить вспять вызванные рассеянным склерозом повреждения тканей головного мозга.
«Такой результат можно считать беспрецедентным. Это большое событие, — говорит он. – Еще одной важной составляющей этого подхода будет лечение на самой ранней стадии и с помощью самого эффективного из известных на сегодняшний день средств».
Исследование проходило при финансовой поддержке компаний Genzyme и Bayer Schering Pharma AG – владельцев коммерческих прав на алемтузумаб.
На пресс-конференции, состоявшейся в среду, медицинский директор Genzyme доктор Сьюзен Моран рассказала о случае смерти пациента в ходе испытаний.
Пациент умер от аутоиммунно-обусловленного заболевания крови, известного под названием «идиопатическая тромбоцитопеническая пурпура» (ИТП). Д-р Моран считает, что смертельного исхода можно было избежать, если бы ИТП изначально присутствовала в перечне возможных побочных действий алемтузумаба.
«К сожалению, у пациента были симптомы ИТП, но он не обращался за медицинской помощью до момента постановки диагноза, так как это состояние не числилось среди возможных побочных явлений», — сказала она.
Как только риск развития этого осложнения стал очевидным, всех пациентов, принимавших участие в исследовании, стали тщательно обследовать на наличие ИТП. Были выявлены еще пять аналогичных случаев, с которыми удалось справиться путем проведения адекватного лечения.
Тщательное наблюдение за больными
Д-р Моран сообщила, что всех пациентов, которые примут участие в III стадии исследований, а также тех, кто будет получать лечение алемтузумабом, если он будет разрешен в качестве средства против рассеянного склероза, будут тщательно обследовать на наличие этого осложнения.
Исследователи также работают над способами выявления пациентов со склонностью к ИТП до направления на лечение алемтузумабом. Кроме того, будут разработаны правила отбора тех пациентов, для которых польза от раннего агрессивного лечения будет наибольшей.
В редакционной статье, сопровождавшей отчет о результатах исследования, невролог Стивен Л. Хаузер, много лет посвятивший изучению рассеянного склероза, пишет, что уверенности в том, что алемтузумаб станет препаратом первого ряда в лечении ранних стадий рассеянного склероза, пока нет.
Доктор Хаузер занимает должность заведующего отделением неврологии в медицинском центре калифорнийского университета в Сан-Франциско.
«Совокупность токсических эффектов, связанных с применением алемтузумаба, значительно охлаждает энтузиазм в отношении его широкого применения у пациентов с рассеянным склерозом, пока не будут получены более полные данные относительно его безопасности при длительном применении и устойчивости полученного эффекта», — пишет он.
Доктор Джон Ричерт из Американского общества рассеянного склероза (НАРС) считает, что сегодня становится все более очевидным, что агрессивное лечение рассеянного склероза на начальной стадии является более выигрышным подходом, чем выжидательная позиция, позволяющая болезни прогрессировать.
Тем не менее он согласен, что потенциальное значение алемтузумаба в лечении рассеянного склероза еще предстоит выяснить.
Д-р Ричерт является вице-президентом НАРС по исследовательским и клиническим программам.
«Алемтузумаб вполне может оказаться именно тем «революционным» средством для лечения рассеянного склероза, которое мы пытаемся найти, но это будет видно только по результатам III стадии клинических испытаний», — говорит он.
Препарат от рака оказался самым эффективным средством при рассеянном склерозе
2 минуты
1089
Продолжавшаяся в общей сложности четыре года третья фаза масштабных клинических испытаний препарата алемтузумаб (alemtuzumab) подтвердила его большую эффективность для облегчения состояния больных рецидивирующе-ремиттирующим рассеянным склерозом (РС) по сравнению с интерфероном бета-1а (Ребиф) – стандартно применяемом при этом заболевании препарате. Отчеты о двух, проходивших параллельно, циклах тестирования алемтузумаба, проведенных исследователями из Кэмбриджского университета (Великобритания), опубликованы 1 ноября в журнале The Lancet.
Алемтузумаб – лицензированное средство, в течение нескольких десятков лет используемое для лечения хронического лимфоцитарного лейкоза и Т-клеточной лимфомы. Оно содержит моноклональные гуманизированные антитела, связывающиеся с гликопротеином CD52, который экспрессируется на поверхности нормальных и злокачественных В- и Т-лимфоцитов, естественных киллеров, моноцитов и макрофагов.
Однако со временем было замечено, что алемтузумаб также оказывает положительный эффект на состояние больных РС, что было подтверждено в ходе первых, также проводившихся специалистами из Кэмбриджа, клинических испытаний, завершившихся в 2008 году. Ученые полагают, что этот феномен основан на том, что алемтузумаб избирательно уничтожает зрелые лимфоциты, участвующие в иммунном ответе при РС, не затрагивая их предшественников в костном мозге. После этого популяция иммунных клеток восстанавливается, но уже не содержит лимфоцитов, атакующих миелиновые оболочки, что напоминает своеобразную «перезагрузку» иммунной системы.
В ходе последней фазы клинических испытаний, призванной окончательно подтвердить эффективность алемтузумаба при РС, в одном случае действие препарата сравнивалось с Ребифом у больных на ранней стадии заболевания, прежде не получавших никакого лечения, а во втором – у тех, кому проведенное лечение не помогло.
В обоих случаях алемтузумаб продемонстрировал вдвое большую эффективность в предупреждении рецидивов заболевания, чем Ребиф. Кроме того, общее состояние пациентов с запущенной стадией РС после двух лет приема алемтузумаба улучшилось по сравнению с началом лечения. По словам руководителя исследований, доктора Элэсдэйра Коулса (Alasdair Coles), ни один из появившихся в последние годы на рынке новых препаратов от РС не показал столь хороших результатов в сравнении с Ребифом, как алемтузумаб.
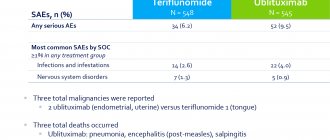
В то же время в интервью BBC Коулс подчеркнул, что алемтузумаб – просто наиболее эффективный препарат для больных рецидивирующе-ремиттирующим РС из всех существующих на данный момент, но отнюдь не панацея. Кроме того, клинические испытания выявили довольно серьезные побочные эффекты алемтузумаба. Речь идет о различных инфекционных осложнениях, аллергических реакциях и аутоиммунных заболеваниях, в основном связанных с дисфункцией щитовидной железы, а также иммунной тромбоцитопении.
По мнению Коулса, алемтузумаб, в основном, может применяться в качестве альтернативного препарата для тех пациентов, кому не помогло стандартное лечение, а в более редких случаях – в качестве первого и основного лекарства. Кроме того, подчеркнул Коулс, алемтузумаб не эффективен при прогрессирующем РС.
Производитель алемтузумаба, Genzyme (подразделение французского фармгиганта Sanofi), в августе отозвал препарат с рынков США и Евросоюза для того, чтобы получить на него лицензию на применение в качестве средства от РС от соответствующих регуляторов. Как отмечается в редакционной статье The Lancet, посвященной завершению клинических испытаний алемтузумаба, после лицензирования цена на препарат может вырасти и стать слишком высокой для большинства пациентов и систем здравоохранения.
За последнее время было предложено три новых лекарственных средства от РС. В 2010 году на рынок США был выпущен препарат финголимод (торговое название «Гиления») производства Novartis. 12 сентября 2012 года американские надзорные органы одобрили препарат терифлуномид, выпускаемый Sanofi под торговым названием Aubagio. Ожидается, что европейский регулятор примет решение по поводу терифлуномида в первом квартале 2013 года. 21 сентября 2012 года две международные группы специалистов отчитались об успешных итогах третьей, последней, фазы клинических испытаний в качестве средства от РС обычно применяющегося при лечении псориаза препарата BG-12 (диметилфумарата).
{#vrez.57990}