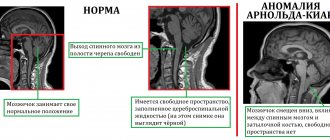
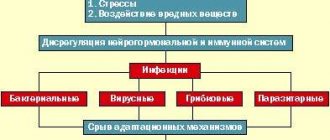
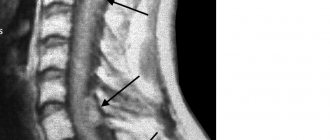
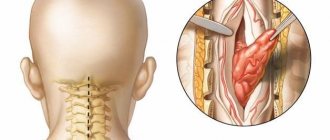
Проблема лечения больных, перенесших позвоночно-спинномозговую травму, является одной из самых сложных в системе нейрореабилитации. Такие пациенты психологически и/или экономически зависимы от своих близких и от социума, так как зачастую значительно ограничены в перемещениях и у них нарушено естественное функционирование жизненно важных систем организма [1, 2].
Многочисленные современные исследования продемонстрировали большие перспективы использования электрической стимуляции спинного мозга в двигательной реабилитации пациентов с отдаленными последствиями травмы спинного мозга. Доказано, что через несколько лет после травмы, после полного паралича, пациенты могут самостоятельно стоять, ходить после курса реабилитации с применением эпидуральной электрической стимуляции спинного мозга [3—5]. Доказано, что механизм действия эпидуральной и чрескожной электрической стимуляции спинного мозга (ЧЭССМ) единый [6]: ЧЭССМ также, как и эпидуральная электрическая стимуляция, может успешно применяться для восстановления двигательных функций пациентов, парализованных после травмы спинного мозга вследствие его полного моторного поражения [7—9].
Особенностью большинства предшествующих работ, показавших возможности электрической стимуляции спинного мозга в восстановлении произвольных движений и самостоятельного поддержания вертикальной позы, является то, что регулярные, часто ежедневные, стимуляционные воздействия и сопутствующие двигательные тренировки длились по 5—9 мес и все двигательные тренировки осуществлялись усилиями 2—3 методистов в присутствии физиолога или врача [4, 5, 10]. То есть впечатляющие результаты были достигнуты за длительный промежуток времени с привлечением большого числа специалистов. Фактически, подавляющее большинство работ в этой области — дорогостоящие научные исследования, проведенные в специфических экспериментальных условиях на селектированных в соответствии с требованиями конкретного исследования пациентах. Остается неясным, насколько вне ограничений и условий эксперимента эффективен курс электрической стимуляции спинного мозга для восстановления двигательной активности пациентов, перенесших травму спинного мозга.
Травма спинного мозга сопровождается не только двигательными нарушениями. Важным является оценка эффективности и безопасности процедур электрической стимуляции спинного мозга прежде всего для восстановления опорожнения мочевого пузыря, кишечника и половой функции у пациентов с травмой спинного мозга, так как наибольшие страдания спинальным пациентам приносят нарушения именно этих функций [11]. Ранее было показано, что стимуляция спинного мозга с параметрами, используемыми для восстановления двигательных функций, влияет на мочевыделительные функции [12, 13]. Недавно опубликованы результаты уродинамического исследования, показавшего, что у пациентов со спинномозговой травмой, не контролирующих функции мочевого пузыря, однократная ЧЭССМ на уровне позвонков Тh11—12 уменьшает гиперактивность детрузора, регулирует рассогласованность детрузора и сфинктера, увеличивает наполняемость мочевого пузыря и облегчает мочеиспускание [14]. Таким образом, можно ожидать, что краткосрочный курс электрической стимуляции спинного мозга, направленный на восстановление двигательной активности, может положительно влиять на реабилитацию выделительных функций.
Цель исследования — определить эффективность использования ЧЭССМ в сочетании со стандартной реабилитацией пациентов, перенесших спинномозговую травму. Дополнительная цель — оценить влияние ЧЭССМ на выделительные функции у пациентов со спинномозговой травмой.
Материал и методы
Исследования проведены на базе СПб ГБУЗ «Городская больница № 40». Цель, задачи и протокол исследования были одобрены научной проблемной комиссией (протокол № 142). От пациентов получено информированное письменное согласие на участие в исследовании.
Критерии включения в исследование: возраст от 18 лет, средне- и нижнегрудной уровень травмы, срок травмы более 9 мес, тяжесть травмы спинного мозга по шкале Американской ассоциации спинальной травмы (American Spinal Injury Association — ASIA) — В или С, тонус мышц нижних конечностей по модифицированной шкале Эшворта — 2 или 3 балла.
Критерии исключения: выраженные сопутствующие заболевания в стадии декомпенсации, повреждения кожных покровов в зоне расположения электродов, наличие нестабильности в элементах опорно-двигательного аппарата, психические заболевания.
В исследовании приняли участие 15 пациентов со спинномозговой травмой в позднем периоде (табл. 1;
Таблица 1. Описание участников исследования. Изменение показателей двигательной активности до и после курса лечения Примечание. * — пациенты проходили реабилитацию амбулаторно. Курсивом выделены пациенты женского пола, фоном — различия показателей до и после курса лечения, жирным шрифтом — положительная динамика, обычным шрифтом — отрицательная динамика. пациенты ранжированы внутри каждой группы по длительности периода после травмы). Все пациенты проходили стандартный курс восстановительного лечения. Восстановительный курс состоял из занятий лечебной физической культурой, механотерапии, в том числе роботизированной («Lokomat», Hocoma, Швеция), массажа, физиотерапии, выполняемых ежедневно, по 10 процедур на курс. Длительность исследования составила ~2 нед.
Основную группу (№№ 1—7 в табл. 1) составили пациенты, согласившиеся на проведение процедуры ЧЭССМ. Они получали стандартный курс терапии и процедуры ЧЭССМ. Пациенты контрольной группы (№№ 8—15 в табл. 1) получали только стандартное лечение.
Для ЧЭССМ применялся аппарат БиоСтим-5 (ООО «Косима»). Электроды (WFB02 QWER, Китай; BF4, LEAD-LOC, Inc., США) с адгезивным токопроводящим слоем фиксировали накожно. Стимулирующий электрод (катод) в виде диска диаметром 2,5 см располагали на средней линии позвоночника между остистыми отростками на 3 уровнях: С5—6, Th11—12 и L1—2. Индифферентные электроды (аноды) помещали симметрично над гребнями подвздошных костей. Стимуляция осуществлялась прямоугольными импульсами (монополярными и/или биполярными) длительностью 1 мс, заполненными несущей частотой 10 кГц. Величину тока подбирали индивидуально, чтобы он не был болезненным и в то же время вызывал сокращение мышц нижних конечностей. Диапазон амплитуды использованных токов составлял 30—120 мА. В течение процедуры величину тока постепенно увеличивали на 20—40 мА. Частота импульсов составляла 15—30 Гц. ЧЭССМ проводили одновременно с двигательной тренировкой на тренажере для активно-пассивной реабилитации верхних и нижних конечностей (Thera vital, «Medica Medizintechnik», Германия). Режим тренировки подбирали индивидуально в зависимости от функциональных способностей больных и поставленных реабилитационных задач. Также для улучшения статики использовали упражнения сидя на стуле, стоя в коленоупоре с постепенным уменьшением площади опоры. При выборе параметров стимулирующих воздействий ориентировались на результаты использования ЧЭССМ для регуляции локомоторных [8] и постуральных функций [10] у пациентов с вертебро-спинальной патологией.
Длительность комплексной процедуры составляла 30 мин, на курс 10 процедур, проводимых ежедневно 5 раз в неделю.
В оценке неврологического статуса пациентов до и после курса лечения применялись стандартные шкалы. Для определения тяжести спинальной травмы по показателям чувствительности и мышечной силы использовали шкалу ASIA/ISNCSCI (International Standards for Neurological and Functional Classification of Spinal Cord Injury — Международные стандарты неврологической и функциональной классификации повреждений спинного мозга). Для определения мышечной спастичности применяли шкалу Эшворта. Силу мышц-сгибателей и мышц-разгибателей бедер, голеней и стоп оценивали по 6-балльной шкале Британского совета медицинских исследований (Harrison scale) [15]. Также в состав стандартного неврологического осмотра входило определение уровня гипо- и анестезии, наличия глубокой чувствительности и мышечно-суставного чувства. Пациенты заполняли дневник мочеиспускания, в котором отмечали позывы к мочеиспусканию и его контроль. Количество остаточной мочи контролировали с помощью катетеризации мочевого пузыря или ультразвукового исследования. Все исследования проводили перед началом реабилитационного курса и сразу после его завершения.
Статистический анализ изменений мышечной силы и чувствительности проводили с использованием критерия Стьюдента и непараметрического критерия Вилкоксона, сравнивая значения для обеих ног пациента, не усредняя их. Различия между показателями считались статистически значимыми при р
<0,05 по каждому из критериев. Остальные показатели сравнивали с применением критериев Манна—Уитни или Вилкоксона.
Результаты
Средний возраст пациентов в контрольной группе составил 27,9±3,80 года, в основной группе — 29,9±8,07 года. Усредненный период после травмы 2,8±2,21 и 1,9±1,06 года в контрольной и основной группах соответственно. Статистически достоверных отличий между группами по этим параметрам нет. Показатели спастичности в контрольной и основной группах составили 2,7±0,39 и 2,1±0,35 балла по шкале Эшворта соответственно. Исходно по балльным оценкам мышечной силы, чувствительности, регистрируемым показателям мочевыделительной системы группы были однородны между собой, не имели статистически значимых различий (см. табл. 1 и 2).
Таблица 2. Изменения показателей чувствительности и выделительной функции до и после курса лечения Примечание. * — 0 — контроль отсутствует, 1 — частичный контроль, 2 — полный контроль; ** — 0 — >100 мл, 1 — 50—100 мл, 2 — <50 мл. Фоном выделены различия показателей до и после курса лечения, жирным шрифтом — положительная динамика, курсивом — пациенты женского пола.
В ходе проведения восстановительного лечения никакие нежелательные явления (болезни, травмы, незапланированные оперативные вмешательства и др.) не произошли. Отмечено увеличение спастичности на 1 балл в конце курса у 1 пациента из основной группы (О8) и 2 больных из контрольной группы (К5, К9).
По результатам исследования мышечной силы все пациенты основной группы, у которых в начале курса регистрировалась мышечная сила в нижних конечностях, отметили ее улучшение до 2—3 баллов (пациенты О5, О8, О10, О12), еще у 2 больных, у которых ранее отсутствовала мышечная активность в нижних конечностях, появилась мышечная сила до 2 баллов (пациенты О2, О4). Субъективно пациенты отмечали, что во время проведения процедуры ЧЭССМ им легче заниматься на тренажере, стоять или выполнять другие задания врача, они начали ощущать напряжение, работу мышц нижних конечностей, улучшилась их регуляция, что значительно повлияло на эмоциональный настрой пациентов и дальнейшую мотивацию к занятиям.
В контрольной группе у 1 пациента, у которого регистрировалась мышечная сила в начале курса, также отмечено ее увеличение до 2 баллов (пациент К10).
Сравнение балльных оценок мышечной силы, зарегистрированных до и после курса с помощью статистических критериев, выявило в основной группе достоверный прирост силы мышц-сгибателей и мышц-разгибателей бедра и мышц-разгибателей голени (p
<0,05 как по критерию Вилкоксона, так и по критерию Стьюдента). Статистический анализ изменений мышечной силы в контрольной группе показал достоверный прирост силы мышц-сгибателей и мышц-разгибателей бедра по критерию Вилкоксона (
p
<0,01) и недостоверный по критерию Стьюдента (
p
=0,838). Из-за впечатляющих различий между значениями вероятностей, рассчитанных по 2 критериям, заключение о статистической значимости изменений показателей мышечной силы в контрольной группе не сделано.
При исследовании чувствительности (см. табл. 2) у 1 пациента основной группы уровень анестезии опустился на 1 сегмент. Еще у 2 пациентов появились глубокая чувствительность и мышечно-суставное чувство в коленных суставах (пациенты О2, О10). Сравнение балльных оценок чувствительности, зарегистрированных до и после курса с помощью статистических критериев, не выявило достоверных различий.
В контрольной группе изменение чувствительности после курса отмечено не было.
Прирост по шкале ASIA в основной группе составил от 1 до 8 баллов. Пациентам О2 и О4 переквалифицировали уровень и степень тяжести травмы по этой шкале с В на С (см. табл. 1).
Прирост по шкале ASIA в контрольной группе не превысил 1 балла.
После анализа дневников мочеиспускания, которые вели пациенты, было выявлено, что в основной группе у 1 из 3 больных, не контролировавших мочеиспускание, появились позывы к мочеиспусканию, также у него восстановился частичный контроль мочеиспускания (пациент О2). Еще у 1 пациента (О3) также появился частичный контроль мочеиспускания. В обоих случаях эффект ЧЭССМ на мочевыделительную функцию был отмечен после 3—5 процедур. В начале курса у 4 пациентов основной группы (О2, О3, О5, О8) количество остаточной мочи составляло более 100 мл. В конце курса ЧЭССМ у 2 пациентов (О3 и О8) после мочеиспускания оставалось от 50 до 100 мл мочи, а у 1 больного (О2) — менее 50 мл, что соответствует нормальным показателям и позволило ему реже катетеризироваться. В целом по группе различия анализируемых показателей мочевыделительной функции статистически недостоверны.
В контрольной группе анализируемые показатели мочевыделительной функции остались без изменений после курса лечения.
Основные исследования болевого синдрома по шкале VAS
Все пациенты с положительным тест-периодом отмечали появление чувства легкого покалывания и/или теплых волн в той части тела, где они обычно чувствовали боль. Эти ощущения были комфортными для пациентов. Сразу после операции у этой группы больных показатели VAS были не выше 5 баллов, также показатели уровня удовлетворения были в пределах 50-90%. Катамнез в нашей группе больных составил от 1 до 26 месяцев.
Шестеро пациентов (9,7% от общего числа больных и 11,5% от пациентов с положительным тестовым периодом) в сроки 15-21 месяцев после операции стали отмечать уменьшение противоболевого эффекта от проводимой стимуляции. Мы расценили это явление как «эффект привыкания к стимуляции». Таким образом, в нашей серии из 62 пациентов стойкого эффекта от противоболевой стимуляции удалось добиться у 46 больных (74,2%). Возможно, с увеличением срока наблюдения за оперированными больными мы получим уменьшение количества хороших результатов.
Таким образом, отбор пациентов для применения данной методики должен производиться с крайней тщательностью в строгом соответствии со следующими критериями:
- инвалидизирующий характер болевого синдрома;
- отсутствие грубых психологических расстройств у пациента;
- пациент должен адекватно оценивать свое состояние и возможности предстоящего хирургического лечения;
- наличие хорошего противоболевого эффекта в тестовом периоде;
- пациент в ходе операции и в послеоперационном периоде должен быть способен правильно выполнять инструкции врача и периодически проходить контрольное обследование .
Этот метод не является панацеей от всех бед, а его клиническая эффективность, по данным масштабных и многолетних исследований, не превышает 55-70%, т.е. потенциальный процент фиаско довольно высок. Ввиду этого тщательный отбор пациентов является пусть не абсолютной, но все же страховкой от получения отрицательного результата и разочарования как пациента, так и хирурга.
Ссылки по теме:
- Cтеноз спинномозгового канала
- Эффективность эпидуральной электростимуляции при миелопатии различного генеза
- Опыт применения хронической эпидуральной нейростимуляции
Также стоит почитать:
Обсуждение
Основным результатом проведенного исследования является доказательство эффективности использования ЧЭССМ в двигательной нейрореабилитации. В результате проведенного курса лечения у ряда пациентов отмечалось улучшение двигательной и выделительной функций. Так, после 2-недельного курса ЧЭССМ в сочетании с двигательной терапией и стандартным курсом восстановительного лечения, состоящего из массажа, лечебной физической культуры, механотерапии, у 6 из 7 пациентов отмечено увеличение мышечной силы нижних конечностей, у 3 — улучшение показателей чувствительности. После завершения курса 2 пациентам степень тяжести травмы уменьшена с ASIA B до ASIA C.
Ранее проведенное исследование, в котором была использована ЧЭССМ в ходе короткого курса двигательной реабилитации, было направлено на изучение сочетанного влияния стимуляции спинного мозга и активации серотониновых рецепторов, поэтому в нем не было группы пациентов, которым не проводили стимуляцию [16]. Группу участников составляли как пациенты с травмой спинного мозга, так и больные с ятрогенной миелопатией, курс состоял из 16—17 получасовых процедур ЧЭССМ на фоне механотерапии, половина пациентов получали буспирон — агонист серотониновых рецепторов. В результате курса в среднем по группе было получено достоверное увеличение мышечной силы, чувствительности. Однако невозможно связать достигнутые после курса реабилитации результаты только с ЧЭССМ из-за отсутствия контрольной группы пациентов, которым ЧЭССМ не проводили.
Таким образом, мы впервые в контролируемом исследовании показали, что ЧЭССМ эффективна в краткосрочном курсе реабилитации двигательных функций у пациентов с тяжестью травмы спинного мозга ASIA В и С. Если обратиться к исследованиям, в которых было продемонстрировано, что многомесячный курс электрической стимуляции спинного мозга приводит к восстановлению самостоятельной ходьбы у пациентов с тяжелыми двигательными нарушениями [3—5], станет очевидным, что длительный процесс восстановления ходьбы состоял из переходивших один в другой коротких курсов, в ходе которых решались определенные реабилитационные задачи. У пациентов последовательно восстанавливали: произвольные движения ног в условиях их внешней поддержки (когда сила тяжести была компенсирована), способность поддержания вертикальной позы, независимой регуляции шагательных движений для правой и левой ноги по отдельности. Это дает основание полагать, что 2—3-недельные курсы ЧЭССМ можно применять в условиях стационарной или амбулаторной реабилитации спинальных пациентов для многоэтапного восстановления тяжелых двигательных нарушений, усложняя восстанавливаемые двигательные навыки на каждом последующем этапе.
В основной группе у 1 пациента увеличилась спастичность нижних конечностей на 1 балл после курса ЧЭССМ. Следует отметить, что и в цитированном выше исследовании [16] также зарегистрировано увеличение спастичности на 0,5 балла после курса ЧЭССМ. В нашем исследовании также и в контрольной группе наблюдался прирост спастичности в конце курса у 2 пациентов. Представляется маловероятным, что это связано именно со стимуляцией спинного мозга. Известно, что в некоторых случаях электрическую эпидуральную стимуляцию спинного мозга применяют для уменьшения спастичности. В частности, было проведено исследование возможности использования электрической стимуляции спинного мозга для уменьшения спастичности у пациентов с детским церебральным параличом и заболеваниями и травмой спинного мозга [17]. Показано, что стимуляция на уровне Th11 с частотой 100—130 Гц, длительностью импульса 120—300 мс, амплитудой 1,5—4 В на протяжении нескольких лет приводила к снижению спастичности в обеих группах. У спинальных пациентов спастичность уменьшилась с 3,71±0,61 балла перед имплантацией стимулятора до 2,26±0,56 балла после 1—9 лет стимуляции. Однако авторы недавно опубликованного обзора [18] большого числа публикаций, в которых были описаны случаи уменьшения спастичности нижних конечностей вследствие электрической стимуляции спинного мозга, сомневаются в обоснованности выводов этих исследований из-за недостатков методологии проведенных исследований, из-за технологических ограничений имплантируемого оборудования и отсутствия полного понимания механизмов спастичности. Таким образом, влияние ЧЭССМ на спастичность предстоит еще исследовать.
Спинальные травмы в большом числе случаев вызывают нарушения произвольного мочеиспускания [19, 20]. В норме функционирование мочевого пузыря связано с сегментами спинного мозга T11—L2 и S2—S4 [21]. Для реабилитации двигательных функций нижних конечностей, как правило, проводят электрическую стимуляцию спинного мозга на уровне T12—L4 [4—6]. В связи с этим закономерны ожидания того, что, стимулируя спинной мозга для восстановления двигательных функций, возможно влиять на выделительные функции. В исследованиях на спинальных животных было показано, что электрическая стимуляция спинного мозга с параметрами, используемыми для двигательной реабилитации, влияет на функцию мочеиспускания [12, 13]. Уродинамическое исследование было проведено на спинальных пациентах в процессе процедуры ЧЭССМ на уровне позвонка Т11 [14]. В этом исследовании было получено, что стимуляция с частотой 30 Гц уменьшает гиперактивность детрузора, диссинергию детрузора и сфинктера, а стимуляция с частотой 1 Гц инициирует опорожнение мочевого пузыря. В нашем исследовании было получено, что курс ЧЭССМ с аналогичными параметрами стимуляции приводит к частичной нормализации мочевыделительной функций у 3 из 7 пациентов. Таким образом, двигательная реабилитация с применением ЧЭССМ может сопровождаться улучшением выделительных функций и очевидно, что требуются дальнейшие исследования для того, чтобы использовать ЧЭССМ для регуляции произвольного мочеиспускания после травмы спинного мозга.
Современные возможности нейростимуляции
Костецкая Ксения Андреевна специалист отдела «Нейро», компания ИМПЛАНТА (St. Jude Medical)
В практике многих спинальных хирургов нередки случаи, когда пациенту проведены неоднократные оперативные вмешательства: микродискэктомия, радикулолиз, фасетэктомия, а боли, стойкие и упорные, продолжают мучить его, ухудшая качество жизни, заставляют человека чувствовать себя беспомощным в обществе. Не смотря на быстрое развитие современного хирургического оборудования, по данным статистики, нейрогенная боль после оперативного вмешательства развивается в 20–40% случаев. Такой синдром называют «Синдром Оперированного Позвоночника» или FBSS (Failed Back Surgery Syndrome).
Если опираться на английское название синдрома, можно подумать, что эти боли — результат неудачной операции. Это совсем не так: операции, как правило, проведены блестяще: хирургу удаётся стабилизировать позвонки или провести виртуозное удаление грыжи, но боль, нейрогенная боль, простреливающая, жгущая, начинает развиваться, несмотря на отсутствие физиологической причины.
Международная ассоциация по изучению боли даёт такое определение FBSS: «Поясничные (или шейные) боли неизвестного происхождения либо персистирующие боли, которые сохраняются, несмотря на проведённое оперативное вмешательство, или возникающие после данного вмешательства в той же самой анатомической области».
Пациенты, у которых развивается Синдром Оперированного позвоночника, как правило, обращаются к неврологу, проходят курс фармакотерапии (нестероидные противоспалительные препараты, миорелаксанты, наркотические анальгетики, антидепрессанты) и/или пользуются физиотерапевтическими аппаратами, что часто оказывает положительный эффект. Но со временем могут развиться медикаментозно-резистентные формы болевого синдрома. По данным американской статистики, ежегодно насчитывается до 50 тысяч таких случаев.
На этом этапе лечения у пациента не остаётся больше других вариантов контроля боли, кроме хирургических. Один из способов устранения невралгии — прервать передачу болевых сигналов. Например, провести процедуру невротомии — её делают на нервной ткани, чтобы предотвратить передачу болевого сигнала. Но это рискованно, а самое главное, данная процедура необратима.
В результате, после длительного безуспешного консервативного и хирургического лечения, через 3–6 месяцев пациент с FBSS может стать инвалидом пожизненно!
Единственным обратимым методом управления хронической болью на сегодняшний момент является нейромодуляция (или нейростимуляция). Принцип действия — тот же: пресекается болевой сигнал, идущий в головной мозг. Но! В организме не происходят необратимые изменения, связанные с операцией. Врач (а после и сам пациент) при помощи имплантированного устройства «закрывает дверь» перед болью: пациент перестаёт ощущать боль в связи с тем, что сигнал не может пройти. Так как устраняем мы именно боль, а не маскируем воспалительный процесс, то результат достигнут: без побочных действий (нет химического изменения), всё обратимо (все клетки организма, все нейроны целы, можно выключить стимуляцию — и всё вернётся; следовательно, если через 15, 20 лет будет создана новая технология, пациент сможет её попробовать, так как отсутствуют необратимые процессы).
Принцип действия стимуляции
Боль — это сигнал, который идет от анатомической зоны через спинной мозг к головному, а тот воспринимает его как болевой. Чтобы прервать этот сигнал до того, как он дойдет до головного мозга, можно послать дополнительный электрический импульс прямо к спинному мозгу именно в том месте, где нервные окончания больного органа входят в него (болевой сигнал не сможет пройти, и головной мозг не получит сигнал о боли). Принцип действия основан на теории Рональда Мельзака (Великобритания) и Патрика Уолла (Канада), которая была опубликована в 1965 году в американском журнале «Science». И через два года, опираясь на эту теорию, американский хирург Норм Шили проводит операцию по стимуляции спинного мозга для контроля за болью у пациента, страдающего раком. Вскоре стимуляторы спинного мозга начали активно применяться в противоболевой терапии. Сейчас в мире ежегодно имплантируется около 100 000 систем, а к следующему десятилетию (по прогнозам специалистов) эта цифра возрастёт до 240 000, за счёт увеличения больных с хроническими заболеваниями, расширения географического применения данной терапии.
Сертифицированная для управления хронической болью в спине, шее, руках и ногах нейростимуляция является проверенной терапией, которая уже более 40 лет применяется врачами по всему миру для улучшения качества жизни пациента. В России нейростимуляция входит в квоту по нейрохирургическому высокотехнологичному лечению.
Первую операцию по SCS (стимуляция спинного мозга) в СССР провел в 1987 году в НИИ Нейрохиругии им. Н. Н. Бурденко нейрохирург, профессор В. А. Шабалов. С 1991 года в России стали применять отечественные модели «Нейроэлект» (разработчик — В. А. Шабалов совместно с Всероссийским научно-исследовательским институтом оптикофизических измерений). К сожалению, материалы и качество моделей не приносили стабильный долгосрочный эффект. Начиная с 1995 года, стали доступны американские имплантируемые системы. Но все равно, это были лишь единицы: всего 5–10 штук в год. И только с 2001 года при финансировании Министерства Здравоохранения и Академии наук РФ количество таких операций и клиник (в которых они проводились) резко возросло: с 1 клиники в 2001 году до 18 к настоящему времени. Количество же имплантированных систем SCS в России к 2013 году превысило 1000. Сейчас стимуляция спинного мозга проводится на современных высокотехнологичных аппаратах повсеместно. Однако, нейростимуляция — не излечение причины, вызывающей боль, и не лечение заболевания. Она является терапией, которая создана для маскировки боли (блокирует болевые сигналы до того, как они достигнут головного мозга). В основном, нейростимуляцию применяют для терапии Синдрома Оперированного Позвоночника (FBSS) или пост-ламинэктомического синдрома и других нейропатий.
Нейростимуляция снимает только нейропатическую боль, другие же виды боли (такие, как зубная, кишечная, периодическая, острая при травмах и пр.) останутся, чтобы организм мог правильно справляться с внешними и внутренними факторами.
Рис. 1.Пульт пациента (St. Jude Medical Inc.) — устройство, при помощи которого пациент регулирует стимуляцию в заданных врачом пределах
Рис. 2. Генератор импульсов. Имплантируется в подкожный карман. Самый маленький стимулятор (Eonmini St. Jude Medical Inc.) – всего 10 мм в толщину
Рис. 3. Электроды для имплантации в эпидуральное пространство (St Jude Medical Inc.)
Операция по имплантации системы проводится, как правило, в два этапа:
1. На тестовом этапе она позволяет врачу вместе с пациентом оценить результат от терапии и понять, помогает ли ему этот метод. Тестовая имплантация — это операция под местной анестезией, когда нейрохирург, спинальный хирург или анестезиолог через иглу Туохи устанавливает специальный тестовый электрод на соответствующий позвоночный уровень, руководствуясь соматотопической картой. При синдроме оперированного позвоночника, как правило, это уровень Th11-L1. Далее электрод подключается к внешнему устройству, и невролог или клинический инженер компании-производителя начинает стимуляцию, проверяя, покрывает л стимуляция (парестезии) всю зону боли. Если нет, то под контролем рентгена хирург корректирует локализацию контактов электрода. Тестовый период может длиться от 2–3 до 7 дней. В это время пациент и врач принимают решение, устанавливать ли постоянную систему;
2. Имплантация постоянной системы, когда хирург выбирает, какой электрод лучше установить пациенту. Это зависит от характера боли: при более комплексной можно установить электрод с большим количеством контактов, при болях более точечной локализации можно снова по игле имплантировать цилиндрический электрод, далее туннелировать его к генератору импульсов. Современные модели генераторов совсем не заметны под одеждой. К примеру, самый маленький стимулятор — всего 10 мм в толщину (Eonmini™ от St. Jude Medical Inc.).
Рис. 4. Программатор врача – компьютер, на котором врач задаёт все параметры стимуляции: частоту, ширину импульса, размер шага и терапевтическое окно интенсивности стимуляции
К основным преимуществам нейромодуляции можно отнести:
- нейростимуляция — это минимально инвазивный современный метод лечения хронических болей в спине;
- отсутствие деструкции нервной ткани;
- полная обратимость эффекта;
- коррекция лечения неинвазивна (к инвазивной коррекции можно отнести изменение положения электрода);
- соотношение «эффективность — стоимость». Генератор может работать от 10 лет и дольше (подзаряжаемые модели); пациент значительно сокращает или совсем перестаёт принимать медикаментозные препараты; уменьшается количество дней пребывания в больнице.
- и самое главное — улучшается качество жизни!