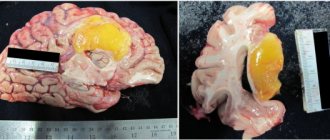
Лучевой (радиационный) некроз, представляющий собой очаговое структурное поражение в месте локализации опухоли, является отдаленным осложнением со стороны центральной нервной системы (ЦНС) после радиотерапии либо радиохирургии.
Отек тканей и присутствие новообразования вызывают в паренхиме органов ЦНС, находящейся в ложе опухоли, изменения, которые повышают вероятность развития лучевого некроза. Радиационный некроз может возникнуть в том случае, когда радиотерапия назначается по поводу первичных новообразований ЦНС, метастатических поражений головного мозга либо опухолей головы и шеи. Лучевой некроз может развиться после любого применения ионизирующего излучения для лечения опухолей или использования любого протокола такого лечения.
Диагностика лучевого некроза и его лечение представляют значительные трудности, поскольку проявления этого осложнения радиотерапии часто перекрываются симптомами рецидива опухоли. Ошибочный диагноз (рецидив новообразования вместо лучевого некроза) может стать причиной назначения неправильного лечения, способного представлять опасность для жизни пациента.
Симптомы лучевого некроза
Нужно понимать, что лучевой некроз является отдаленным осложнением радиотерапии, развитие которого нередко происходит месяцы, а то и годы спустя после завершения лечения ионизирующим излучением. Чаще всего он проявляется в период от 6 месяцев до 2 лет после завершения последнего курса радиотерапии.
В современной медицинской литературе встречаются данные о частоте развития лучевого некроза, которые отличаются значительной вариативностью – от 5% до 37% всех пациентов, получавших радиотерапию по поводу внутричерепных опухолей.
При этом некоторые авторы сообщают о том, что до 10% всех случаев этого осложнения радиотерапии были бессимптомными и выявление лучевого некроза в подобных случаях целиком является заслугой прогресса в методах нейровизуализации. Лечащим врачам необходимо принимать во внимание возможное отсутствие симптомов лучевого некроза у больных, несмотря на развитие патологического процесса.
В тех случаях, когда развитие лучевого некроза все же сопровождается симптоматикой, у пациентов чаще всего наблюдаются следующие признаки:
- головная боль;
- тошнота;
- когнитивные нарушения;
- судорожные припадки;
- очаговая неврологическая симптоматика, связанная с локализацией очага некроза;
- изменение личности;
- апатия;
- гемипарез.
Мозговые кровоизлияния при лучевом некрозе явление редкое, но, тем не менее, встречающееся в практике нейроонкологов.
Лучевые повреждения кожи
Лучевые повреждения кожи, часто называемые лучевым ожогом, могут иметь различное клиническое проявление.
Лучевые повреждения кожи (развитие лучевых ожогов). Рис. 5. Эритема. Рис. 6 — 8. Развитие пузырей. Влажный радиоэпидермит. Рис. 9. Эрозия. Рис. 10. Рубец ; видны дисхромия, телеангиэктазии и каемка гиперпигментации.
Эритема — временное покраснение кожи на месте облучения; развивается на 13—14-й день после однократного и через 2—6 недель после фракционного облучения. Стойкая эпиляция развивается при однократном или фракционном облучении волосистой части головы. Сухой эпидермит развивается через 7—10 дней после однократного или через 2—3 недели после фракционного облучения. Клинически проявляется эритемой, отечностью кожи с последующим пластинчатым шелушением. Восстановление облученной кожи неполное. Кожа остается атрофированной, сухой, эпилированной. Позднее появляются телеангиэктазии, неравномерная пигментация. Влажный радиоэпидермит сопровождается резким покраснением и отеком кожи, появлением пузырей, наполненных прозрачной желтоватой жидкостью, которые быстро вскрываются, при этом обнажается базальный слой эпидермиса. Через 1—2 дня начинается эпителизация. Влажный эпидермит заканчивается стойкой атрофией волосяных фолликулов, сальных и потовых желез, значительным истончением кожи, потерей ее эластичности, депигментацией (дисхромией), появлением телеангиэктазии. Позднее может выявиться гиперкератоз (избыточное ороговение) и склероз подлежащей подкожной жировой клетчатки. После облучения жестким рентгеновским или амма-излучением спустя 6—9 мес. и позже выявляется медленно прогрессирующая атрофия мышечной ткани и остеопороз костей. Наиболее резкая степень атрофии мышц и задержка роста костей наблюдаются у детей. При лечении злокачественных опухолей влажный радиоэпидермит допустим только на малых по размеру полях облучения. Лучевая язва может развиваться остро в ближайшие дни и недели после интенсивного однократного облучения, подостро через 6—10 недель, а также через несколько лет после облучения. Острое течение характеризуется интенсивным покраснением кожи вскоре после облучения, сопровождающимся резким отеком, сильными болями, нарушением общего состояния. На отечной, с застойной гиперемией коже появляются крупные пузыри нередко с геморрагическим мутным содержимым. По отторжении эпидермиса обнажается некротизированная поверхность, покрытая неснимающимся налетом, в центре которой образуется язва. В течение длительных сроков происходит отторжение некротизированной ткани, образование вялых и нестойких грануляций и эпителизация язвы. Нередко заживления не происходит. Подостро развивающаяся лучевая язва часто является исходом длительно протекающего влажного эпидермита. В окружающих язву тканях в пределах облученного поля в течение ближайших месяцев развивается резко выраженная лучевая атрофия. Поздняя лучевая язва обычно развивается на фоне резко атрофированных тканей на месте облучения. Образование язвы происходит по типу острого лучевого некроза тканей в области всего поля облучения, захватывающего не только кожу, но и подлежащие ткани, подкожную клетчатку, мышцы, кости. В ряде случаев на атрофированной коже появляется поверхностная экскориация (ссадина), которая постепенно углубляется и увеличивается в размерах, превращаясь в глубокую язву. Лучевая атрофия кожи и лучевая язва нередко заканчиваются развитием лучевого рака. Результатом лучевого воздействия на кожу и подкожную жировую клетчатку нередко является индуративный отек тканей. Индуративный отек развивается в результате поражения не только кровеносных, но и лимфатических сосудов, что ведет к нарушению оттока лимфы, отеку и склерозу кожи и подкожной клетчатки. Кожа и подкожная клетчатка облученного поля постепенно становятся плотными, возвышаются над уровнем нормальной кожи, при надавливании остается ямка. Кожа гиперпигментирована, покрыта телеангиэктазиями или приобретает красновато-синюшный оттенок, становится болезненной. Под влиянием травмы или без видимой причины в области индуративного отека может возникать некроз кожи, ведущий к образованию глубоких лучевых язв.
Эритема не требует специального лечения; необходима только защита от любого вида раздражения кожи: солнечной инсоляции, теплового, химического и механического воздействия, обмывания, особенно с мылом. Все перечисленные раздражители способствуют увеличению степени повреждения. Допускается смазывание покраснений поверхности кожи индифферентным жиром, маслами, преднизолоновой мазью. Влажный эпидермит лечат открытым способом, без повязки. Мокнущую поверхность обрабатывают ежедневно или через день спиртовым раствором генцианвиолета. При необходимости накладывают повязки с линиментом алоэ, тезановой эмульсией, облепиховым маслом, рыбьим жиром. Эпителизация заканчивается через 1 — 2 недели. Лечение лучевой язвы заключается в радикальном хирургическом удалении язвы и окружающих измененных лучевым воздействием тканей. Нерадикальное вмешательство, т. е. оставление части облученных тканей, ведет к расхождению швов и образованию сначала незаживающего дефекта, позднее вновь превращающегося в язву. После иссечения язв малого размера возможно наложение швов без дополнительной пластики. При больших язвах операция заканчивается пластикой лоскутами из окружающих тканей или лоскутами по Филатову. Перед операцией необходима длительная подготовка, заключающаяся в борьбе с инфекцией, для чего используются антибиотики; для очищения язвы от некротизированных тканей применяют 5—10% раствор дибунола в линетоле, пелоидин, винилин (бальзам Шостаковского); для стимуляции образования грануляций применяют метациловую мазь, рыбий жир, линол, линимент алоэ. Для улучшения кровоснабжения окружающих язву тканей и увеличения ее подвижности по отношению к подлежащим тканям, а также улучшения нервной трофики применяют циркулярную -новокаиновую блокаду 0,25% раствором.
Поделиться ссылкой:
Лучевой некроз: диагностика
Основными методами диагностики лучевого некроза являются нейровизуализация и гистологическое исследование ткани «подозрительных» участков.
МРТ является наиболее распространенным методом диагностики лучевого некроза. Однако при этом нужно отметить, что изображения ЛН, полученные с помощью этого метода, очень часто напоминают картину рецидива опухоли – с увеличением контрастности в пораженном участке и отеком, расположенным по периферии патологического очага.
В результате из-за низкой прогностической ценности обычной МРТ большее значение приобрели более современные методы диагностики:
- магнитно-резонансная спектроскопия;
- перфузионная МРТ;
- позитронно-эмиссионная томография (ПЭТ).
Диагностика лучевого некроза с помощью первого из этих методов (магнитно-резонансной спектроскопии) основана на том, что жизнеспособная опухоль обладает ненарушенной сосудистой системой, вследствие чего объем кровотока в ней больше по сравнению с некротической тканью.
Для дифференциального диагноза в этом случае используется показатель относительного церебрального объема крови, полученный с помощью динамической контрастной МРТ. При опухолях этот показатель выше по сравнению с лучевым некрозом.
Оценка состава метаболитов в метастатической опухоли головного мозга с помощью магнитно-резонансной спектроскопии является еще одним ценным методом дифференциальной диагностики. Повышенные показатели соотношения холин/креатинин и холин/N-ацетиласпартат могут свидетельствовать в пользу рецидива опухоли, а не лучевого некроза.
Перспективным направлением в дифференциальной диагностике лучевого некроза можно назвать и ПЭТ с фтортирозином. Некоторые авторы сообщают о чувствительности этого метода в 100% и специфичности 93% при диагностике ЛН.
Что же касается использования гистологического исследования для диагностики лучевого некроза, то надо подчеркнуть, что объем биоптата должен быть таким, чтобы иметь возможность полностью исключить рецидив опухоли и вместе с тем не вызвать клинически значимого неврологического дефицита. При заборе биоптата следует избегать нарушения целостности структур мозга, расположенных в глубине центральной части таламуса, двигательной области коры головного мозга, затылочной области и центров речи.
Обычно в образцах ткани, пораженной некрозом, не обнаруживается преобладание злокачественных клеток. Вместе с тем, ткани облученной опухоли могут содержать некротизированные участки, что не всегда указывает на лучевой некроз.
При лучевом некрозе исследование биоптата может выявлять утолщение кровеносных сосудов с пролиферацией эндотелия и/или гиалинизацию с фиброзом и умеренной инфильтрацией лимфоцитов и макрофагов.
Лучевой некроз: лечение
Для эффективного лечения лучевого некроза первостепенное значение имеет правильно поставленный диагноз, так как ошибочный диагноз рецидива опухоли и последующее противоопухолевое лечение могут привести к нежелательным тяжелым последствиям.
В отношении пациентов без симптомов лучевого некроза, у которых в период наблюдения с помощью МРТ выявляется некротическая масса, может быть избрана выжидательная тактика. Если выбор стратегии лечения не зависит от того, выявлен ли у больного лучевой некроз или рецидив глиомы, состояние такого больного нужно контролировать с помощью серии МРТ.
Однако тактика лечения должна быть другой при наличии таких симптомов как синдром объемного образования в полости черепа, повышенное внутричерепное давление, неврологические нарушения. В подобных случаях возможно использование таких методов лечения (раздельно или в комбинации):
- назначение кортикостероидов;
- в случае неэффективности стероидов можно рассмотреть использование бевацизумаба (моноклональное антитело, которое селективно связывается с биологически активным фактором роста эндотелия сосудов (VEGF) и нейтрализует его);
- гипербарическая оксигенотерапия (подача кислорода под давлением 2-3 атм. На курс лечения: 20-30 сеансов продолжительностью 90-120 минут каждый).
Хирургическое лечение лучевого некроза имеет свои преимущества и недостатки. Удаление некротической массы способствует быстрому снижению повышенного внутричерепного давления и восстановлению неврологических функций. Вместе с тем, такая операция связана с риском серьезных осложнений и проводится в основном пациентам, у которых консервативное лечение оказалось безрезультатным.
Факторы риска лучевого некроза
К настоящему времени установлены несколько факторов риска, которые способствуют развитию лучевого некроза. По мнению ведущих специалистов в области нейроонкологии, несмотря на то, что эти факторы риска были в основном обнаружены у пациентов с артериовенозными мальформациями, которым назначалось радиохирургическое лечение, а также пациентов с глиомой, они могут быть экстраполированы и на всех больных с метастазами в головной мозг:
- объем опухоли и поглощенная доза;
- применение химиотерапии наряду с радиотерапией;
- локализация опухоли (риск развития ЛН является максимальным при облучении лобного отдела коры мозга и значительно меньшим при облучении стволовой области мозга);
- гистологические особенности опухоли.
Установлено также, что радиотерапия некоторых метастатических опухолей головного мозга связана с повышенным риском развития лучевого некроза в зависимости от формы первичной опухоли. Увеличение частоты развития ЛН наблюдается при радиотерапии метастазов в головной мозг при следующих опухолях:
- карцинома почки;
- аденокарцинома легкого;
- меланома кожи с мутацией онкогена BRAF V600;
- HER2-позитивный рак молочной железы.
Кроме того, способствует развитию лучевого некроза и повышенная индивидуальная чувствительность к действию ионизирующего излучения.
Источник: Radiation Necrosis
Влияние лучевой терапии на твердые ткани зубов у пациентов с раком орофарингеальной области
Е. Ф. Дмитриева
аспирант кафедры ортопедической стоматологии и ортодонтии Федерального государственного бюджетного образовательного учреждения высшего образования «ЮУГМУ» Министерства здравоохранения Российской Федерации
Н. С. Нуриева
д. м. н., профессор кафедры ортопедической стоматологии и ортодонтии ГБОУ ВПО «ЮУГМУ» Минздрава России (Челябинск)
Введение
Онкологическая заболеваемость у людей постепенно увеличивается в течение последнего столетия. Число заболеваний злокачественными опухолями головы и шеи также неуклонно увеличивается, достигая в большинстве регионов России 20—25 % от всех злокачественных опухолей. В частности, опухоли органов орофарингеальной области составляют 5,1 % от всех опухолей [3].
Современная стратегия лечения больных плоскоклеточным раком органов головы и шеи включает применение хирургического метода, лучевой терапии, химиотерапии и таргентной терапии, а также различные варианты комбинированного лечения. Среди различных методов лечения в клинической онкологии лучевая терапия занимает одно из ведущих мест. По данным ВОЗ, 70—75 % онкологических больных нуждаются в проведении лучевой терапии.
Несмотря на последние достижения онкологии, в настоящее время после комбинированного и лучевого лечения злокачественных новообразований челюстно-лицевой области невозможно избежать осложнений, связанных с ионизирующим излучением. В частности, побочным результатом лучевой терапии является интенсивное разрушение зубов. Поражение твердых тканей зубов связывают как с непосредственным действием на них лучистой энергии, так и с последующим иммунодепрессивным состоянием, нарушением минерального и белкового обменов, количества и состава слюны, функционального состояния важнейших физиологических систем организма [4].
Цель исследования
Изучить особенности клинической картины лучевого кариеса зубов в зависимости от времени, прошедшего после завершения лучевого лечения опухолей орофарингеальной зоны, что позволяет провести диагностику заболевания на ранних стадиях.
Материал и методы исследования
Данная работа основана на опыте клинического наблюдения 60 пациентов со злокачественными новообразованиями орофарингеальной зоны II—IV стадии в возрасте от 22 до 75 лет. В подавляющем большинстве случаев гистологическое заключение — плоскоклеточный рак (в 97 % случаев), в 3 % случаев идентифицирована карцинома. Осмотренные пациенты получали СПЛИТ-курс ДЛТ: за 2 этапа на опухоль подводится СОД = 66—70 изоГр, на л/узлы шеи СОД = 44—50 изоГр, на метастазы в л/узлы шеи СОД = 60—70 изоГр, на очаги лимфаденопатии более 2,0 см СОД = 60 изоГр. Все пациенты завершили курс лучевой терапии. Наблюдение проводили через 1, 6, 12 и 24 месяца после завершения лучевой терапии. Ни один из пациентов не получал поддерживающей стоматологической терапии на этапах лечения и после выписки. Лучевой кариес при осмотре диагностирован в 100 % случаев через два года после завершения специализированного лечения (рис. 1, 2).
Изменения в облученных зубах мы подразделили следующим образом.
Лучевой кариес 1-й степени: потеря блеска, прозрачности эмали, появление меловидных пятен как проявление деминерализации поверхностного слоя эмали. При этом никаких признаков разрушения и образования дефекта эмали нет. При зондировании полости не определяются. В области шейки зубов по эмалево-цементному соединению обнаруживается застревание зонда. Пациенты, как правило, не жалуются на спонтанную боль или боль от температурных раздражителей. Температурная проба (на холодное) положительная.
Лучевой кариес 2-й степени: в основном прогрессирование кариозного процесса наблюдается в пришеечной области. Характерны разрушение участков эмали, полости с подрытыми краями. Распад не затрагивает дентин. Изменения в цвете могут быть от коричневого до черного. Могут отмечаться повышенная стираемость эмали на режущем крае и хрупкость, отколы эмали. Пациенты, как правило, не жалуются на спонтанную боль или боль от температурных раздражителей. Температурная проба (на холодное) либо слабоположительная, либо отрицательная.
Рис. 1. Пациент В., 63 лет. Лучевой кариес. Рис. 2. Пациент У., 68 лет. Лучевой кариес.
Лучевой кариес 3-й степени: полное разрушение эмали, распад эмалево-дентинной границы. Дентин размягчен при зондировании. Положительная перкуссия. Без самопроизвольного вскрытия пульпы. Пациенты, как правило, не жалуются на спонтанную боль или боль от температурных раздражителей. Тепловая проба отрицательная. Отсутствие боли основано на потере жизнеспособности и чувствительности пульпы.
Лучевой кариес 4-й степени: полное разрушение коронки зуба, пульповая камера вскрыта, дентин размягченный, темного цвета. Боль либо отсутствовала, либо имели место периодонтитные боли.
В таблице представлены сроки возникновения лучевого кариеса.
Результаты и обсуждение
Лучевой кариес зуба (c. dentis radialis) — генерализованный кариес зуба, развивающийся как осложнение рентгено- или радиотерапии челюстно-лицевой области; протекает с пигментацией и размягчением поверхностных слоев и образованием глубоких пришеечных полостей.
Патогенез лучевого поражения зубов до сих пор окончательно не выяснен. Так, обсуждаются данные о сосудистых, морфологических и дегенеративных нарушениях в пульпе, предшествующих поражению твердых тканей зубов [1]. В полости рта на фоне проведения лучевой терапии челюстно-лицевой области создается кариесогенная ситуация за счет развития радиоиндуцированной ксеростомии, нарушения микрофлоры полости рта, затруднения гигиены полости рта, снижения самоочищения ротовой полости и общего снижения иммунитета. Несмотря на большое количество исследований по этиологии радиоиндуцированного кариеса, до сих пор имеются противоречия в мнениях о первопричинности его возникновения: прямое воздействие радиации или длительное опосредованное воздействие неблагоприятных факторов, возникающих в полости рта после облучения, основным из которых является радиоиндуцированная ксеростомия.
До настоящего времени не сложилось единого мнения о характере лучевого повреждения зубов. Одни авторы рассматривают такие поражения как некариозные, другие — как остро протекающий кариозный процесс.
Клинические проявления последствий радиационного воздействия могут быть весьма различны и зависят от полученной дозы облучения и вида ионизирующей радиации [2]. Обычно спустя 3—6 мес. после лучевого воздействия эмаль зубов утрачивает характерный блеск, становится тусклой, серовато-блеклого цвета. Отмечаются ломкость, стертость жевательной и вестибулярной поверхности зубов. На этом фоне появляются участки некроза, вначале локальные, а затем по типу циркулярного поражения зубов. Указанные поражения обычно темного цвета, заполненные рыхлой некротической массой, безболезненные.
Отсутствие болевого симптома — характерная особенность радиационного поражения, свидетельствующая о подавлении функции одонтобластов. Постепенно участки некроза расширяются и захватывают значительную часть зуба. Удаление некротических масс из очага поражения, как правило, безболезненно, поэтому требует особой осторожности. Если не применять радикальных вмешательств, через 1—2 года окажутся пораженными более 96 % зубов [7].
Таблица № 1. Сроки возникновения лучевого кариеса у пациентов, получавших лучевое лечение опухолей орофарингеальной зоны, %
| Клинические проявления | 0 — 1 мес. | 1 — 6 мес. | 6 — 12 мес. | 12 — 24 мес. |
| Лучевой кариес 1-й степени | — | 58 % | 8 % | — |
| Лучевой кариес 2-й степени | — | 8 % | 58 % | 16 % |
| Лучевой кариес 3-й степени | — | — | 33 % | 17 % |
| Лучевой кариес 4-й степени | — | — | — | 67 % |
Проблеме профилактики и стоматологического лечения этого патологического состояния посвящены единичные исследовательские работы. Профилактика лучевого кариеса включает в себя стоматологическое обследование пациентов до онкологического лечения с обязательной санацией полости рта [5], проведением профессиональной гигиены, удалением полностью разрушенных зубов и корней зубов, а также зубов с III степенью подвижности, пломбированием всех кариозных полостей. После этого пациентам также подбираются индивидуальные средства гигиены и изготавливаются защитные индивидуальные ортопедические устройства [6].
Профилактика лучевого кариеса непосредственно после онкологического лечения должна быть направлена на лечение ксеростомии, тщательную гигиену полости рта, снижение употребления углеводистой пищи, реминерализующую терапию.
Своевременное лечение кариеса зубов даже на самых ранних стадиях развития патологического процесса является важной задачей у этого контингента больных [5].
Заключение
Таким образом, проведенное нами исследование позволяет сделать следующие выводы. Лучевой кариес, возникающий после лучевого лечения пациентов с раком орофарингеальной зоны, определяется в 100 % случаев при дозе облучения до 70 Гр, вызывая поражения твердых тканей зубов от 6 до 24 мес. Описанная клиническая картина лучевого кариеса зубов в зависимости от времени, прошедшего после завершения лучевого лечения, позволяет провести диагностику и лечение лучевого кариеса на ранних стадиях, что улучшает качество жизни пациентов.