Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Дисклеймер
Обычно «Биомолекула» не публикует статьи по одинаковым инфоповодам, но в этом году мы приняли две работы, базирующиеся на одной и той же публикации в Nature 2021 года. Статья, которую вы читаете, — обзорная, а вот и ее парная новостная [16].
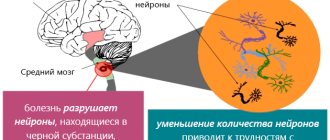
Болезнь Паркинсона является вторым по распространенности нейродегенеративным расстройством. Она характеризуется отмиранием нейронов в черной субстанции мозга. Существующая терапия направлена на ограниченное сдерживание заболевания. Эффективного лекарства до сих пор не существует. Недавнее исследование может в корне изменить плачевную ситуацию. Хао Цянь из Калифорнийского университета в Сан-Диего (США) вместе с коллегами из Пекинского университета (Китай) продемонстрировал успешное превращение астроцитов в нейроны in situ на мышиной модели болезни Паркинсона. Однако начнем с общей характеристики этого заболевания.
Новое в лечении болезни Паркинсона
Европейские исследования ведутся по направлениям мягкой импульсной электростимуляции нейронов и генной терапии. Но до тех пор, пока причины болезни Паркинсона остаются неясными, средств, позволяющих полностью ее вылечить, найдено не будет. Доступное в данный момент лечение помогает улучшить качество жизни и отдалить развитие болезни, так что пациенты, которым этот диагноз был поставлен недавно, имеют все шансы сохранить способность к самообслуживанию на долгие годы.
Болезнь Паркинсона является одним из самых тяжелых недугов пожилых людей. Для того, чтобы облегчить его проявления и улучшить общее самочувствие больного, требуются профессиональный уход и солидная материально-техническая база. Все это могут предоставить современные гериатрические центры.
Болезнь Паркинсона: история и молекулярный патогенез
В 1817 году английский врач Джеймс Паркинсон [1] опубликовал работу «Эссе о дрожательном параличе», в которой дал описание неврологического недуга, а также провел анализ и выявил общие закономерности. В названии отражено необычное сочетание основных симптомов — тремор, скованность мышц и неспособность удерживать равновесие [2].
Долгое время медицина не понимала причины этого расстройства. Прорыв в изучении болезни Паркинсона произошел уже в XX веке .
Кстати, одним из ученых, который помог разгадать тайны патогенеза болезни Паркинсона, стал русский невропатолог Константин Николаевич Третьяков, занимавший в 1916–1923 годах должность заведующего лабораторией мозга имени Шарко кафедры нервных болезней Парижского университета (Франция). Он предложил нигральную теорию патогенеза болезни Паркинсона, согласно которой, проявления заболевания были связаны с утратой черной субстанции головного мозга.
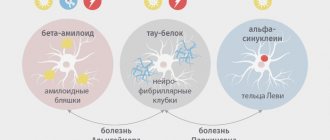
Сегодня известно, что болезнь Паркинсона развивается вследствие дегенерации дофаминергических нейронов в черной субстанции, что приводит к снижению уровня вырабатываемого дофамина — нейромедиатора, ответственного за чувство удовлетворения и привязанности. Клинические проявления связаны с нейротоксическим эффектом: по мере прогрессирования заболевания в клетках накапливается белок альфа-синуклеин [3]. Альфа-синуклеин в норме задействован в механизме транспорта и высвобождения везикул с нейротрансмиттерами. Однако у пациентов с болезнью Паркинсона наблюдается фосфорилирование и аномальное свертывание этого белка с образованием агрегатов — телец Леви (рис. 1). В 2021 году группа ученых из научно-исследовательского института Скриппса (США) обнаружила, что фосфорилированная форма альфа-синуклеина локализуется в митохондриях, вызывая их фрагментацию [4].
Рисунок 1. Тельце Леви в нейроне черной субстанции головного мозга
[15]
Средства для внутреннего приема при болезни Паркинсона
При болезни Паркинсона массово гибнут нервные клетки. Ускоряется процесс, если человек испытывает стресс и негативные эмоции, так как в таких случаях нарушается кровоснабжение головного мозга, из-за чего он не получает полноценного питания и достаточного количества кислорода. Отвары и настои окажут успокаивающее действие, улучшат питание и дыхание нейронов, благодаря чему затормозят патологические изменения. Не стоит ждать быстрого действия, так как лекарственные растения характеризуются накопительным эффектом. Первые результаты станут видимыми через месяц, но стойкий эффект удастся получить только через 6-12 месяцев. В домашних условиях рекомендуется проходить лечебные курсы 3-4 раза в год, чередуя месячный прием препарата с перерывами.
Травяные чаи
Чаи готовят из липы, ромашки, тимьяна, душицы, тысячелистника, шалфея, зверобоя, чередуя их. Для приготовления целебного напитка сухие листья травы заваривают кипятком и настаивают 10 минут. Каждое утро рекомендуется выпивать чашечку горячего ароматного чая.
Лечебные настои
Измельчают 3 столовые ложки травы (зверобоя, крапивы или шалфея) засыпают в термос и запаривают кипятком. Оставляют на 30-60 минут. Принимают по 60-80 миллилитров 3 раза в день перед едой.
Настои ослабляют тремор и скованность, помогают преодолеть депрессию и чувство страха, улучшают память и мыслительную деятельность.
Овсяный отвар от Паркинсона
Стакан овса хорошо промывают и заливают литром воды комнатной температуры. Настаивают 9 часов, а затем в течение получаса кипятят на слабом огне. Обматывают посуду полотенцем, чтобы сохранить тепло, и оставляют еще на 12 часов. Пьют трижды в день по 100 миллилитров перед принятием пищи.
Овсяный отвар очищает сосуды и ослабляет дрожание конечностей, укрепляет опорно-двигательную систему.
Возможности сегодняшней терапии
Сейчас существует только симптоматическое лечение, направленное на облегчение имеющихся проявлений заболевания. Одним из наиболее эффективных и широко применяемых лекарств является леводопа, или 3-гидрокси-L-тирозин [5]. Леводопа — биологический предшественник дофамина. Помимо леводопы, иногда используется ряд других лекарственных средств. Агонисты дофаминовых рецепторов имеют химическую структуру, похожую на дофамин, и за счет этого могут стимулировать его рецепторы [6]. Ингибиторы моноаминоксидазы B способны блокировать высвободившийся дофамин и продлевать время его действия. Ингибиторы катехол-О-метилтрансферазы подавляют распад принятой леводопы и удлиняют время ее действия в организме.
Также для терапии болезни Паркинсона применяют так называемые нейротрофические факторы — регуляторные белки, которые поддерживают жизнеспособность и функционирование нейронов. Хотя было проведено множество исследований по использованию нейротрофических факторов в клинической практике, у них есть ряд недостатков. Во-первых, они нуждаются в точной доставке к месту назначения. Для этого используют специальные катетеры. Во-вторых, нейротрофические факторы целесообразно использовать только в том случае, если у пациента еще не повреждены аксоны дофаминергических нейронов. Если же транспортная система в черной субстанции нарушена или уничтожена, то такое лечение не даст никаких положительных эффектов [7].
Часть из вышеперечисленных способов борьбы с болезнью широко используется, однако ничего из этого не поможет вернуть человеку его утраченные нейроны. Поэтому были попытки разработать терапию, направленную на восстановление популяции дофаминергических нейронов. В 2021 году группа ученых из японского Университета Киото [8] пересадила в мозг пациента индуцированные плюрипотентные стволовые клетки (ИПСК) [9], способные превращаться в любую клетку организма. Перед тем как применять ИПСК для лечения болезни Паркинсона у человека, были проведены исследования эффективности и безопасности этой терапии на приматах [10]. У семи людей изъяли ИПСК для их последующего превращения в клетки нейронного ряда. Для трансформации использовали двойное подавление сигнального пути SMAD, участвующего в процессах клеточного роста, дифференциации и смерти. За специализацию дофаминергических нейронов в черной субстанции отвечает сигнальный путь Sonic hedgehog (Shh). Подавление SMAD и активация Shh привели к дифференцировке ИПСК в клетки-предшественники дофаминергических нейронов, которые начали синтезировать нейронные маркеры [11]. Однако трансплантация стволовых клеток для лечения болезни Паркинсона у человека не применяется из-за сложности и недостаточных данных об эффективности.
Болезнь Паркинсона (БП) — хроническое прогрессирующее заболевание головного мозга, преимущественно характеризующееся дегенерацией дофаминергических нейронов черной субстанции с образованием в них особых внутриклеточных включений (телец Леви) и проявляющееся сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью [1, 5, 6, 20]. Помимо классических двигательных нарушений для БП характерен широкий спектр немоторных проявлений, включающий психические, вегетативные, сенсорные симптомы, нарушения сна и бодрствования [2, 24].
Одним из частых немоторных проявлений БП является болевой синдром. Частота боли у больных БП, по данным разных авторов [12, 16, 19, 21, 25], колеблется от 40 до 70% и превышает таковую в общей популяции (10-40%). Примерно у 10% пациентов боль бывает начальным симптомом БП, предшествующим двигательным нарушениям, но при этом она чаще всего возникает на стороне будущих моторных симптомов [24, 27]. В дебюте БП особенно часто встречаются боль и болезненность мышц в плечелопаточной области, особенно двуглавой мышцы плеча [18]. Боль часто игнорируется врачами, ведущими пациента с БП, но именно она нередко бывает основным симптомом, снижающим качество жизни пациента [21].
Несмотря на высокую частоту боли, ее причины, связь с самим заболеванием и подходы к ее коррекции остаются плохо разработанными.
Цель настоящего исследования — определение частоты хронического болевого синдрома и разработка подходов к его диагностике и систематизации.
Материал и методы
В исследование были включены 130 пациентов с БП, 57 мужчин и 73 женщины, средний возраст которых был 63,5±9,1 года, а средняя длительность заболевания — 3,8±2,3 года. Диагноз БП ставился в соответствии с клинико-диагностическими критериями Банка головного мозга общества БП Великобритании. Стадия заболевания по шкале Хена-Яра колебалась от 2 до 4 и в среднем составила 2,4±0,7; оценка по шкале UPDRS — 46,7±15,6 балла.
Критерием отбора пациентов было отсутствие деменции согласно критериям МКБ-10.
Болевой синдром был выявлен у 68 (52%) из 130 пациентов, 31 мужчины и 37 женщин, которые составили основную группу
. Их средний возраст был 63,1±9,1 года, длительность заболевания — 3,6±2,4 года, средняя оценка по шкале Хена-Яра — 2,5±0,6. В
группу сравнения
вошел 31 пациент с БП без болевого синдрома — 13 мужчин и 18 женщин, средний возраст которых составил 63,7±9,1 года, длительность заболевания — 3,3±2,8 года, оценка по шкале Хена-Яра — 2,3±0,6. Между этими группами не было достоверных различий по полу, возрасту, длительности и стадии заболевания.
В основной группе 57 (83,8%) пациентов принимали препараты леводопы, 49 (72,1%) пациентов — агонисты дофаминовых рецепторов, 14 (20,5%) пациентов — препараты амантадина. В группе сравнения указанные препараты принимали соответственно 22 (70,9%), 23 (74,1%) и 8 (25,8%) пациентов.
В контрольную группу
для оценки порога болевой чувствительности и состояния вибрационной чувствительности вошли 30 практически здоровых, того же пола и возраста (14 мужчин и 16 женщин; средний возраст 66,3±8,8 года), что и пациенты основной группы.
Количественная оценка двигательных нарушений проводилась с помощью Унифицированной рейтинговой шкалы БП (Unified Parkinson’s Disease Rating Scale — UPDRS), 3-я версия [14]. Оценка болевого синдрома — с помощью специально разработанного суточного дневника оценки боли (ДОБ-БП). Этот дневник позволял оценить продолжительность и интенсивность болевого синдрома в течение суток, связь с приемом препаратов леводопы и региональное распределение боли. ДОБ-БП предусматривал 4-балльную оценку боли: 0 — боль отсутствует, 1 балл — легкая боль, 2 балла — умеренная боль, 3 балла — сильная боль. Локализация боли определялась пациентом по следующим регионам тела: голова, шея, туловище, поясничная область, верхние конечности и нижние конечности. Интенсивность боли определялась также по визуальной аналоговой шкале (ВАШ), при этом обследуемому предлагалось оценить испытываемую на момент осмотра боль в баллах на отрезке от 0 до 10, где 0 баллов — отсутствие боли, а 10 баллов — нестерпимая боль.
Исследование порога болевой чувствительности проводилось с помощью прессальгометрии. На плечо пациента надевалась манжетка, на внутренней поверхности которой был укреплен игольчатый аппликатор и при нагнетании в нее воздуха у пациента возникало болевое ощущение. Порог болевой чувствительности оценивался по давлению в манжетке (в мм рт.ст.) в момент восприятия боли.
Для общей оценки когнитивных функций использовалась шкала краткого исследования психического статуса — MMSE (Mini Mental State Examination) [15]. Для оценки отдельных когнитивных функций применялся тест «кодирование» из Векслеровской шкалы интеллекта для взрослых (Wechsler Adult Intelligence Scale — WAIS), адаптированной в Санкт-Петербургском психоневрологическом институте им. В.М. Бехтерева [4], тест рисования часов [26], тест на зрительную память из шкалы SKT [22], тест на свободные и направленные ассоциации [2]. Исследование качества жизни, связанного со здоровьем, проводилось с помощью шкал EQ-5D [10].
При локальной болезненности или ограничении подвижности в позвоночнике или суставах делалось рентгенографическое или магнитно-резонансное томографическое (МРТ) исследование соответствующих структур.
Статистическая обработка проводилась с помощью программного пакета Statistica 6.0 с использованием критерия Стьюдента, критерия согласия &khgr;2, критерия U, непараметрического критерия знаков, рангового корреляционного анализа (по Спирмену).
Результаты и обсуждение
Из 68 больных с хроническим болевым синдромом у 25 (36,7%) он возник практически одновременно с появлением двигательных нарушений или незадолго до них, у 43 (63,3%) — развился позже, по мере дальнейшего прогрессирования заболевания. В течение года от начала заболевания болевой синдром возник у 25 (36,7%) пациентов, а спустя год — более чем у 43 (63,3%) пациентов.
Болевой синдром чаще локализовался в проксизмальных отделах верхних конечностей — у 31 (43,9%) пациента, чем в дистальных — у 9 (16,3%). Это отличает его от симптомов паркинсонизма, которые при БП первоначально чаще вовлекают дистальные отделы верхних конечностей. На верхних конечностях болевой синдром чаще локализовался в области плеча — у 31 (43,9%) пациента, реже в кисти — у 9 (16,3%). Боль в области бедра выявлялась у 17 (25%) пациентов, в области голени — у 12 (17,6%), стопы — у 10 (14,7%). Боли в поясничной области отмечали 23 (32,8%) пациента. Боль чаще выявлялась или преобладала на стороне выраженных моторных проявлений — у 43 (63%) пациентов, но у 9 (13%) она была более выраженной с противоположной стороны.
Существенного различия по формам заболевания между пациентами с болью и без нее не выявлено: дрожательная форма выявлялась соответственно у 11,7 и 6,5% больных, акинетико-ригидная — у 36,8 и 32,2%, смешанная — у 51,5 и 61,3%. Тем не менее у пациентов с болевым синдромом была выше оценка по III части UPDRS, преимущественно за счет гипокинезии и постуральной неустойчивости, однако не было выявлено различия в выраженности тремора и степени ригидности (табл. 1)
.
При этом выявлена корреляция между интенсивностью болевого синдрома, оцениваемого по ДОБ-БП, и оценкой по III части UPDRS (r
=0,43,
p
<0,01), а также выраженностью гипокинезии (
r
=0,3,
p
<0,05).
Несмотря на то что в целом по группе зависимости болевого синдрома от уровня ригидности не отмечено, у 26 (38%) пациентов боль можно было связать с изменением мышечного тонуса (ригидностью и дистонией) — ввиду совпадения их локализации. Такой тип боли чаще выявлялся в конечностях (25 больных), иногда вовлекая их по гемитипу, реже в области шеи.
Интенсивность болевого синдрома, оцениваемая по ДОБ-БП и ВАШ, зависела также от возраста больных к периоду начала заболевания. Так, у пациентов с более ранним дебютом она была выше (r
=-0,38,
r
=-0,41,
p
<0,01), в то же время интенсивность боли не зависела от длительности заболевания.
У пациентов с болевым синдромом средняя доза леводопы была выше (297,0±207,8 мг), чем у пациентов без болевого синдрома (202,5±177,3 мг), что, вероятно, отражает большую тяжесть симптомов паркинсонизма.
Моторные флюктуации были выявлены у 11 (16,2%) пациентов основной группы и 5 (16,1%) пациентов группы сравнения. Хотя различий по частоте болевого синдрома между пациентами с болью и без боли не было, выявлена достоверная корреляция между оценкой болевого синдрома по ВАШ и оценкой моторных флюктуаций по UPDRS (IV часть) (r
=0,32,
p
<0,001). По данным ДОБ-БП, у 14 (21%) больных (в том числе у 3 лиц, не имевших явных моторных флюктуаций) боль зависела от фазы действия препарата леводопы: она возникала или усиливалась в период ослабления эффекта предшествующей дозы и снижалась на высоте эффекта следующей дозы леводопы.
У больных с болевым синдромом отмечался более низкий порог болевой чувствительности, чем у пациентов без болевого синдрома (табл. 2)
.
Кроме того, порог болевой чувствительности на стороне более выраженных симптомов паркинсонизма был ниже по сравнению с болевым порогом на другой стороне. Обнаруженный факт является весомым подтверждением того, что боль непосредственно связана с основными механизмами развития БП.
У 35 (51%) больных при клиническом осмотре, рентгенографии или МРТ выявлялась скелетно-мышечная патология, связанная с дегенеративно-дистрофическим поражением позвоночника (25 больных), плечевого сустава (5), тазобедренного сустава (4), коленного сустава (3). Однако лишь у 19 (27,9%) пациентов ее можно было признать основной причиной хронического болевого синдрома. В подобных случаях при осмотре выявлялись локальная мышечная болезненность, ограничение подвижности, не связанное с ригидностью или дистонией.
У 13 (19%) пациентов с БП наблюдался необычный тип боли, который невозможно было связать ни со скелетно-мышечной патологией, ни с локальными или регионарными изменениями мышечного тонуса, ни с суточными колебаниями эффекта препаратов леводопы, хотя «конгруэнтность» преимущественному распределению основных симптомов паркинсонизма обычно отмечалась и в этом случае. Для данного типа боли были характерны «размытость» локализации, глубинный ноющий характер болевых ощущений, более высокая их интенсивность (средняя оценка по ВАШ составила 7,4 балла, тогда как оценка боли, связанной с изменением мышечного тонуса, была 5,6±1,4 балла), сочетание с такими субъективными сенсорными жалобами, как онемение или парестезии, наличие своеобразного локализованного компонента акатизии (хотя развернутого синдрома акатизии ни в одном случае не отмечено). Болевой синдром с подобными характеристиками у больных БП описывался некоторыми авторами как «первичная», или «центральная» боль [8]. Ни в одном случае локализация боли не соответствовала распределению симптомов, характерному для заболеваний периферической нервной системы (например, полинейропатии) [8]. Ни у одного из больных состояние не соответствовало критериям синдрома беспокойных ног [7].
Хотя между группами больных БП с болью и без боли не было различий в общем уровне когнитивных функций, оцениваемом с помощью MMSE, у пациентов с болевым синдромом отмечались более выраженные нарушения при выполнении тестов «рисование часов», «кодирование», тестов на речевую активность и зрительную память (табл. 3)
.
Полученные результаты указывают на то, что у больных с болевым синдромом имеются более выраженные когнитивные нарушения, преимущественно нейродинамического и регуляторного характера. В целом выявленные нарушения соответствуют уровню умеренного когнитивного расстройства. Корреляции между интенсивностью боли и показателями выполнения нейропсихологических тестов не отмечено.
Симптомы депрессии отмечались у 49 (72%) больных с болевым синдромом и у 11 (35%) пациентов без болевого синдрома. Средняя оценка по шкале Бека у пациентов с болевым синдромом была выше, чем у пациентов без боли (соответственно 16,8±8,5 и 13,6±7,2 балла, p
<0,01). Более того, выраженность боли, оцениваемая по ДОБ-БП и ВАШ, коррелировала с выраженностью депрессивной симптоматики, определяемой по шкале Бека (соответственно
r
=0,56,
r
=0,51;
p
<0,001). Вместе с тем болевой синдром у пациентов с выраженной депрессией не имел клинических особенностей.
Уровень качества жизни, определяемый по шкале EQ-5D, у пациентов с болевым синдромом был ниже, чем у пациентов без болевого синдрома (p
<0,05). При этом у пациентов с болью при БП снижена повседневная деятельность, повышен уровень тревоги и депрессии, а также боли и дискомфорта. Оценка болевого синдрома по ДОБ-БП негативно коррелировала с уровнем качества жизни, оцениваемого по EQ-5D (
r
=-0,57;
p
<0,01).
Для коррекции основных симптомов паркинсонизма и моторных флюктуаций у 49 (72,1%) пациентов с болевым синдромом были увеличены доза и кратность приема леводопы: средняя суточная доза леводопы была увеличена на 118,8±22,1 мг и составила 415,8±225,1 мг. У 17 (34%) пациентов после коррекции дозы леводопы произошло снижение оценки по ДОБ-БП с 4,9±3,4 до 4,1±2,7 балла (p
<0,05). Положительная реакция на увеличение дозы леводопы отмечена при болевых синдромах, связанных с флюктуациями, локальным или регионарным повышением мышечного тонуса, а также при условно выделенной «центральной» боли.
Таким образом, временнáя связь болевого синдрома с течением заболевания, его основными моторными и немоторными проявлениями, изменением порога болевой чувствительности, а также положительная реакция на противопаркинсоническую терапию позволяют заключить, что, по крайней мере, у большинства больных БП хронический болевой синдром патогенетически связан с самим заболеванием.
На основании проведенного исследования можно выделить 4 основных признака (критерия), которые позволяют установить связь болевого синдрома с БП: 1) развитие боли одновременно с дебютом заболевания и/или на фоне нарастания симптомов паркинсонизма; 2) соответствие локализации («конгруэнтность») боли распределению основных моторных проявлений (преобладание боли на стороне более выраженных симптомов паркинсонизма); 3) уменьшение боли при назначении или коррекции противопаркинсонической терапии либо ее связь с моторными флюктуациями, фазами действия препаратов леводопы или дискинезиями; 4) отсутствие других причин, способных объяснить болевой синдром.
Боль, связанную с БП, можно констатировать при четкой положительной реакции на противопаркинсоническую терапию, в том числе при связи с колебаниями эффекта препарата леводопы. Имелись основания (наличие 3-го критерия) либо при наличии 1-го, 2-го и 4-го критериев. На основе указанных критериев можно было связать болевой синдром с БП у 24 (35,3%) больных.
Анализ клинической феноменологии позволил условно выделить 3 частых типа связанного с БП болевого синдрома: 1) боль при моторных флюктуациях; 2) боль вследствие локальных (регионарных) изменений мышечного тонуса (ригидности или дистонии); 3) «центральная» боль. Кроме того, у 25 (36,8%) пациентов был выявлен лишь один из критериев связи болевого синдрома с БП (исключая 3-й критерий). В этих случаях была констатирована боль, «условно связанная с БП». При этом ее причиной могли быть артрозы крупных суставов и дегенеративные изменения позвоночника, но тем не менее она несомненно усугублялась в связи с развитием БП и такими ее проявлениями, как ригидность и позные деформации. Боль, не связанная с БП, отмечена у 19 (27,9%) пациентов. Она характеризовалась отсутствием временно’й связи с течением заболевания, несоответствием локализации распределению паркинсонических симптомов, отсутствием реакции на противопаркинсонические препараты. Ее основной причиной была вертебральная и/или суставная патология.
Причины развития боли при БП остаются недостаточно понятыми. Болевой синдром при БП объясняется дисфункцией различных уровней нервной системы от периферических нервных волокон до коры головного мозга [8]. В эксперименте показано, что базальные ганглии выполняют важную роль в переработке сенсорной информации и их дисфункция, вызываемая недостаточностью дофаминергической системы, способна приводить к дефициту нисходящих тормозных путей, которые модулируют прохождение импульсации по соматосенсорным болевым путям [8, 11, 25]. В этом убеждают продемонстрированная рядом исследователей и подтверждаемая нашими данными связь между болевым синдромом и снижением порога болевой чувствительности, а также отмеченная в ряде работ [9, 13, 17] тенденция к его нормализации под действием дофаминергической терапии. Возможно, важную роль в развитии болевого синдрома играет нарушение сенсомоторной интеграции [2]. В последние годы у больных БП выявлено вовлечение периферических сенсорных волокон в дегенеративный процесс, однако клиническая значимость этого остается неясной [23]. Ни в одном из наблюдаемых нами случаев не удалось выявить клинические черты, типичные для периферической нейропатической боли (распределение по полинейропатическому типу, наличие аллодинии или гипералгезии и т.д.).
Поскольку доказательств непосредственного поражения соматосенсорной системы при БП нет, обозначать боль, связанную с БП, как «нейропатическую» в соответствии с современным определением последней, нет оснований [8]. Тем не менее, учитывая возможную роль подкорковых структур в развитии болевого синдрома, боль, связанная с БП, может быть определена как «нейрогенная».
Подходы к лечению боли у больных БП зависят от ее предполагаемой причины. Наличие болевого синдрома всегда следует рассматривать как повод для оценки адекватности противопаркинсонической терапии. Это особенно важно при наличии критериев связи болевого синдрома с БП. При возникновении или усилении болевого синдрома в периоды ослабления действия препаратов леводопы необходима соответствующая коррекция противопаркинсонической терапии, направленная на укорочение периода «выключения» (повышение дозы или кратности приема препарата леводопы, добавление агониста дофаминовых рецепторов, ингибитора МАО типа В или ингибитора КОМТ). При выявлении депрессивной симптоматики необходима ее коррекция (агонисты дофаминовых рецепторов, антидепрессанты). При так называемой «центральной» боли усиление дофаминергической терапии не всегда приводит к уменьшению болевого синдрома. В подобных случаях наиболее перспективным представляется назначение антидепрессантов (имеющих норадренергический компонент действия), однако их эффективность следует проверить в специальных исследованиях. Наконец, если боль связана с сопутствующей патологией скелетно-мышечной системы, ее лечение проводится по общим правилам и должно включать комплекс физических методов воздействия, нестероидные противовоспалительные средства, центральные миорелаксанты и т.д.
В заключение следует отметить, что боль у пациентов с БП — частый и гетерогенный феномен, выяснение природы которого позволяет наметить путь к его дифференцированной терапии.
Астроциты — возможное лекарство?
В последнее время было опубликовано несколько научных работ по превращению различных клеток в дофаминергические нейроны. В основном, исследователи останавливали свой выбор на астроцитах — клетках, поддерживающих жизнедеятельность нейронов. Свое название они получили за характерную звездчатую форму (рис. 2). В обязанности этих клеток входит обеспечение метаболических потребностей нейронов, участие в своевременном высвобождении нейротрансмиттеров из нервных окончаний, запас питательных веществ и регуляция активности нейронов.
Рисунок 2. Вспомогательные клетки нервной системы — астроциты. В норме они обеспечивают жизнедеятельность нейронов, но воздействуя на молекулярные процессы, протекающие в астроцитах, можно добиться их «превращения» в нейроны любого типа.
Human Astrocytes
Но больше всего ученых интересует их репаративная функция. В 2014 году группа ученых из Лундского университета и Каролинского института обнаружила, что при повреждении нервной ткани после инсульта астроциты способны замещать погибшие нейроны [12]. При этом у них «выключается» сигнальный путь Notch1, имеющий ключевое значение в процессах пролиферации и дифференцировки клеток. В здоровом головном мозге этот путь активен и блокирует превращение астроцитов в нейроны. Однако после инсульта этот механизм подавляется, и астроциты могут начать трансформироваться в нейроны.
Идея для исследования, проведенного группой из Калифорнийского университета, не нова. Еще в 2021 году группа шведских ученых с помощью вирусных векторов превратила человеческие астроциты в нейроны in vitro. После этого трансформировали и мышиные астроциты, но уже in vivo. Для репрограммирования они использовали три транскрипционных фактора (NEUROD1, ASCL1 и LMX1A) и микроРНК miR218 [13]. Трансформация астроцитов in vitro была улучшена с помощью молекул, способных провоцировать перестройку хроматина и активировать несколько сигнальных путей.
Однако в исследовании 2021 года предлагается куда более простой метод перепрограммирования астроцитов: достаточно просто заблокировать производство одного-единственного белка.
Показаниями к операции
В случае тяжёлых, неподдающихся фармакотерапии моторных флюктуаций и особенно лекарственных дискинезий рекомендуют нейрохирургические методы лечения. Их выполняют врачи в клиниках-партнёрах, находящихся в Москве. Нейрохирурги лечат больных паркинсонизмом стереотаксическим криогенным методом. Они проводят криодеструкцию вентролатерального ядра таламуса и субталамической области с помощью специального прибора. У пациентов после операции отмечается полное или почти полное исчезновение тремора и мышечной ригидности, восстанавливаются функциональные возможности и трудоспособность.
Показаниями к операции являются:
- недостаточная эффективность антипаркинсонических препаратов;
- лекарственные дискинезии;
- плохая переносимость медикаментов;
- выраженный, некурабельный медикаментозно тремор.
В Юсуповской больнице пациентам предоставляется сервис европейского уровня. Врачи используют современные схемы лечения заболевания оригинальными, наиболее эффективными, препаратами. Если вам необходима помощь невролога, специализирующегося на лечении болезни Паркинсона, звоните по номеру телефона.
Механизм трансформации астроцитов
В качестве мишени для репрограммирования астроцитов Цянь и коллеги выбрали РНК-связывающий белок PTB1 [14]. Этот белок синтезируется в астроцитах и ингибирует дифференцировку в нейроны. Снижение производства PTB1 вызывает продукцию его нейронного варианта nPTB1.
Сначала ученые провели трансформацию астроцитов in vitro. Астроциты выделили из среднего мозга и коры мыши и из коры человека. Исследователи использовали РНК-шпильку к гену Ptbp1, который кодирует белок PTB1. РНК-шпильки работают по принципу РНК-интерференции: они взаимодействуют с информационной РНК конкретного гена и вызывают ее деградацию, что приводит к неспособности клетки произвести белок. Уровень PTB1 в астроцитах упал, что привело к трансформации астроцитов в нейроны.
Затем исследователи перешли к экспериментам in vivo: они истощали запасы белка PTB1 в мозге мыши. Симптомы болезни Паркинсона у мышей были вызваны с помощью токсичного аналога дофамина, 6-OHDA, вызывающего гибель дофаминергических нейронов. Цянь и коллеги использовали трансгенных мышей, продуцирующих cre-рекомбиназу. Это позволяло нацелить вирусный вектор непосредственно на астроциты. Чтобы убедиться, что вирус достиг своей цели, в него встроили ген красного флуоресцентного белка. В составе вирусного вектора была маленькая РНК-шпилька (shPTB), которая блокировала ген Ptbp1. Такая стратегия также привела к преобразованию астроцитов в нейронные клетки и восстановлению двигательной активности (рис. 3).
Рисунок 3. Слева: астроциты мыши. Справа: нейроны, полученные в ходе репрограммирования астроцитов.
One-Time Treatment Generates New Neurons, Eliminates Parkinson’s Disease in Mice
Классификация болей
Существует несколько классификаций болей при Паркинсоне, самая популярная – разделение на острую и хроническую формы, при этом хроническая может быть висцеральной и центральной. Также некоторые ученые придерживаются разделения по локализации.
По степени связанности с болезнью Паркинсона, выделяют связанные (при ригидности) и косвенно связанные (появившиеся в результате пролежней, падений и переломов и т.д.). Так, например, если болит рука Паркинсоне, то это может быть связанный симптом, вызванный нервными или мышечными поражениями или косвенно связанный, появившийся на фоне ушиба после падения в результате потери координации движений.
По Левину и Махневу различают вертеброгенные, корешковые и рефлекторные синдромы. А по Дрейку – миогенные, дистонические, корешково-невритические, суставные и редко встречающиеся генерализованные.
Также бывают дневные или ночные боли, вторые характеризуются невозможностью уснуть или частым пробуждением, связанные с акинезией или наоборот, периодическими непроизвольными движениями конечностей.
В 19% случаев возникает необычная форма болезни, определить которую можно по высокоинтенсивной ноющей боли внутренних органов, которая сочетается с сильным мышечным напряжением.
Результаты
Цянь и коллеги обнаружили, что истощение запасов PTB1 в астроцитах стимулирует их трансформацию в нейроны. Результат такой трансформации зависит от области мозга, в которой находятся целевые астроциты. Обнаружено, что астроциты в среднем мозге синтезируют низкие уровни факторов транскрипции Lmx1a и Foxa2. Эти факторы являются маркерами предшественников дофаминергических нейронов во время развития среднего мозга. Однако истощение белка PTB1 усиливало продукцию этих факторов транскрипции в астроцитах среднего мозга. С другой стороны, воздействие на корковые астроциты приводило к увеличению синтеза факторов транскрипции, характерных для корковых нейронов.
Спустя 4 недели после воздействия на астроциты in vitro 50–80% клеток стали морфологически похожи на нейроны и дали положительный результат на нейронные маркеры TUJ1 и MAP2.
При экспериментах in vivo спустя 3 недели после введения shPTB около 20% клеток, получивших красный флуоресцентный белок, синтезировали маркер нейронов NeuN. После 10 недель было уже около 80% клеток с NeuN. При этом клетки переставали продуцировать GFAP — белок, присутствующий в астроцитах.
Спустя 12 недель 30–35% этих клеток трансформировались в дофаминергические нейроны. Другими словами, перепрограммирование астроцитов помогло восстановить более 600 погибших дофаминергических нейронов (рис. 4).
Рисунок 4. Мозг мыши с «односторонней» болезнью Паркинсона. Сверху — до репрограммирования с помощью shPTB. Снизу — после. Зеленым показаны дофаминергические нейроны.
One-Time Treatment Generates New Neurons, Eliminates Parkinson’s Disease in Mice
Более того, новоиспеченные нейроны стали активно производить дофамин. Воздействие 6-OHDA привело к снижению уровня нейромедиатора до 25% от нормальных показателей. После терапии концентрация дофамина поднялась до 65% нормального уровня.
Психотерапия
Нет сомнений в том, что болезнь Паркинсона существенно меняет жизнь человека. Справиться и смириться с этими изменениями очень трудно. Нередко больным нужна помощь психотерапевта. Только работа с хорошим специалистом поможет побороть депрессию. Поддержание бодрости духа — одна из первоочередных задач, которые стоят перед пациентом с таким диагнозом. Врачи давно заметили, что от настроя пациента во многом зависит и успех лечения.
Общие рекомендации
Людям с болезнью Паркинсона придется пересмотреть весь образ жизни. Например, необходимо обращать особое внимание на диету. Пищеварение при этом заболевании страдает значительно, пациенты часто жалуются на запоры. Чтобы избежать этого, необходимо включить в рацион как можно больше продуктов, богатых клетчаткой, — овощи и фрукты, бурый рис, отрубной хлеб, бобы. Нельзя забывать и о белках — лучше всего в виде нежирного мяса и рыбы, а также яиц. Витамины требуются для нормального обмена веществ, особенно важен прием витаминов С и Е. Необходимо пить как можно больше воды, поскольку обезвоживание при болезни Паркинсона — частое явление.
Важен и режим приема прописанных препаратов. Их нужно принимать точно по часам в соответствии с рекомендацией врача.
Будет ли создана новая терапия болезни Паркинсона?
Пока что слишком рано говорить о перспективах использования метода репрограммирования астроцитов для лечения болезни Паркинсона у реальных пациентов. Однако уже сейчас можно сказать, что это исследование помогло понять, как лучше подступиться к созданию новых направлений терапии этого недуга. Хотя эта многообещающая терапевтическая стратегия в будущем может быть применима и для лечения других нейродегенеративных заболеваний, сами авторы указывают, что «применение нашего подхода к людям потребует преодоления многих препятствий, включая возрастные ограничения перепрограммирования и потенциальные побочные эффекты». Вдобавок, в дальнейших экспериментах необходимо определить, сохранят ли перепрограммированные клетки свою функциональную активность в течение длительных промежутков времени.
Лекарственные средства
Подбор медикаментозных средств для лечения болезни Паркинсона зависит от стадии заболевания. В самом начале развития болезни врачи применяют препараты, которые стимулируют синтез дофамина — нейромедиатора, количество которого при паркинсонизме снижается. Используются и препараты, останавливающие распад этого нейромедиатора, предупреждающие его обратный захват, стимулирующие соответствующие рецепторы в мозгу. Эти средства во многом схожи с антидепрессантами.
На ранних стадиях заболевания применяют агонисты дофаминовых рецепторов на основе действующих веществ:
- прамипексол;
- ропинирол;
- пирибедил;
- ротиготин;
- ингибиторы МАО типа Б (действующее вещество разагилин;
- активатор выхода дофамина из нейронального депо — амантадин.
На третьей из пяти стадий развития болезни назначают препарат с активным веществом леводопа. Если заболевание дебютировало в возрасте старше 70 лет, то, как правило, препарат на основе леводопы назначают сразу.