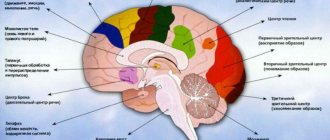
Биологические часы не сбиваются
Натаниэл Клейтман, американский учёный (кстати, иммигрант из России), который занимался изучением сна, как-то раз целый месяц просидел в подземной пещере в надежде узнать, что же происходит с биологическими часами человека. Он предполагал, что, если не видеть солнечного света, восходов и закатов, они собьются — и цикл либо сократится до 21 часа, либо увеличится до 28. К его удивлению, этого не произошло. Наши биологические часы всегда точны: один цикл сон-бодрствование длится 24–25 часов.
В царстве Морфея. Интересные факты о сне и сновидениях
Подробнее
Лишение сна смертельно
В XX веке обнаружено генетическое заболевание, которое называется «фатальная семейная бессонница»: именно оно стало причиной смерти членов более 30 семей по всему миру. Симптомы одинаковы. Сначала люди переставали спать — просто не получалось, затем учащался пульс и росло давление, в следующей фазе больные не могли говорить, стоять и ходить. Заканчивалось всё за пару месяцев: перед смертью люди впадали в состояние, похоже на коматозное, и умирали. Как правило, болезнь затрагивает людей среднего возраста, а иногда и подростков.
Статья по теме
Как правильно засыпать, чтобы утром быть бодрым. Советы сомнолога
Сон — это репетиция
Учёные всё чаще склоняются к тому, что биологическое значение сна состоит в том, чтобы обеспечить выживание вида, будь то крыса или человек. Во сне мы тренируемся избегать опасностей (похоже, для этого и существуют сны с угрожающим содержанием), например переплываем реку или убегаем от опасного животного. Но благодаря особенному состоянию во сне, в котором наши мышцы почти обездвижены, вся эта репетиция происходит на уровне мозга. Таким образом, мы заучиваем способы спасения своей жизни во сне, чтобы когда-нибудь воспользоваться ими в реальной жизни.
Работа подсознания: как сны помогают решать проблемы и выявлять болезни
Подробнее
Как быть, если бессонница беспокоит постоянно?
Когда проблемы возникают краткосрочно (1-2 дня) в этом нет ничего катастрофического.
Но если вы на постоянной основе считаете овечек по вечерам и доходите в своих подсчетах до сотни или вскакиваете раньше будильника с роем мыслей в голове, то ситуация является очень серьезной и требует вмешательства специалиста.
Сон улучшает способности к обучению
Все стадии сна связаны с обучением: чем сильнее мозговая активность во время сна, тем лучше заучивается новое. Обнаружилось, что стадия лёгкого сна ответственна за совершенствование новых навыков у музыкантов, танцоров и спортсменов. Интересно, что подобное происходит не сразу, а спустя день – два после первой тренировки и заучивания пьесы, танца или движения. А во время медленного сна хорошо запоминается фактическая информация: например, даты из учебника истории.
* Книга Андреа Рока «Мозг во сне» предоставлена издательством «Манн, Иванов и Фербер»
Парасомнии представляют собой необычные формы поведения, возникающие в связи с процессом сна. Выделяют парасомнии, связанные с фазой медленного сна (ФМС, медленноволновый сон), фазой быстрого сна (ФБС, сон с быстрыми движениями глаз) и др. Расстройство поведения в фазе быстрого сна (РПБС) представляет собой форму парасомнии и характеризуется двигательной и/или речевой активностью во сне, соответствующей содержанию сновидений. Возникновение расстройства поведения во сне связано с отсутствием физиологического торможения мышечного тонуса в ФБС. РПБС обычно проявляется ищущими, хватающими движениями, жестикуляциями, падениями с кровати, криками, ударами кулаками или ногами, поскольку сновидения часто включают агрессивные компоненты [1]. У ряда больных РПБС проявляется сложными действиями, имитирующими движения во время приема пищи, курения, танцев, сексуального поведения и включающими длительную речь, пение и др. [2].
РПБС начинается обычно в возрасте старше 50 лет, чаще встречается у мужчин, с частотой 0,37—0,5% в популяции. У 40—80% больных в течение 10—12 лет развивается нейродегенеративное заболевание из группы синуклеинопатий: болезнь Паркинсона (БП), деменция с тельцами Леви, мультисистемная атрофия. На основании этих данных РПБС рассматривается в настоящее время как ранний маркер этих нейродегенеративных заболеваний [3].
Патофизиология РПБС при БП до конца не изучена. Полагают, что развитие РПБС обусловлено дисфункцией структур ствола головного мозга, участвующих в модуляции двигательной активности во время фазы быстрого сна (locus subcoeruleus
, педункулопонтинное, гигантоклеточное ретикулярное ядра) и их связей с лимбической системой (в частности, миндалиной), лобной корой, базальными ганглиями [1].
Точная верификация диагноза РПБС производится с помощью видео-полисомнографии (ПСГ) путем выявления тонической и/или фазической электромиографической (ЭМГ) активности, ассоциированной с нарушением поведения. Для клинической диагностики при отсутствии результатов ПСГ применяются критерии предполагаемого РПБС [1, 4, 5].
РПБС считается наиболее специфичным ранним симптомом БП, ключевым симптомом додвигательной стадии заболевания и может предшествовать симптомам паркинсонизма за 10—20 лет [6]. Эта связь и очередность манифестации РПБС и БП могут быть объяснены более ранним вовлечением в нейродегенеративный процесс некоторых ядер ствола мозга, что проявляется, в частности, симптомами РПБС, двигательные же симптомы БП развиваются позже, при поражении нигростриарной системы [1]. У пациентов с диагностированной БП симптомы РПБС встречаются в среднем в 40—60% случаев [7—9]. На ранней стадии заболевания у пациентов, не получавших противопаркинсоническую терапию, частота РПБС, по данным ПСГ, составляет 25% [9].
Несмотря на относительно высокую частоту возникновения РПБС при БП, это расстройство не рассматривается как значимый фактор ухудшения качества жизни больных [10, 11]. В отсутствие тяжелых проявлений РПБС, приводящих к самотравматизации и нарушению качества сна, двигательная активность во сне является чаще причиной психологического и физического дискомфорта не у пациентов, а у их близких. Так, по имеющимся наблюдениям, 65% больных с БП не осведомлены об имеющихся у них нарушениях поведения во время сновидений [12].
Снохождение (лунатизм, сомнамбулизм) в отличие от РПБС является парасомнией, связанной с ФМС. Эта парасомния характеризуется повторяющимися эпизодами сложного, ассоциированного со сном поведения, включающего двигательную активность на фоне частичного (или полного) нарушения сознания, а также амнезии события наутро. Изменение сознания в момент эпизода проявляется отсутствием отклика (или его несоответствующим характером) при попытках вступить с пациентом в контакт. В общей популяции снохождение преимущественно встречается у детей (в 18—29% случаев), среди взрослых его частота составляет лишь 2—4%. Еще реже снохождение в основной популяции возникает впервые у взрослых (в 0,6% случаев) [4].
Приводим описание клинического случая пациента, у которого регулярно повторяющиеся проявления РПБС, наряду с редкими эпизодами снохождения, являлись основными дезадаптирующими нарушениями. В результате неврологического обследования больного, обратившегося за медицинской помощью по поводу проявлений парасомний, был установлен диагноз: БП на ранней стадии заболевания и эссенциальный тремор.
Больной С.,
66 лет, обратился с жалобами на приступы двигательной активности высокой интенсивности, возникающие во время сна и связанные с содержанием сновидений (жестикуляция, вскакивание с постели, нападение на спящего рядом с нанесением повреждений); дрожание кистей рук, усиливающееся при эмоциональном напряжении; ощущение скованности в области шеи и спины.
Из анамнеза заболевания со слов больного, «ночные вздрагивания» беспокоят его с детства. Первый случай агрессивного поведения во сне имел место в 2001 г., когда во время сна он ударил жену, по какой причине, не помнит. После пробуждения пациент мог вспомнить только то, что сновидение имело устрашающий характер. В дальнейшем эпизоды агрессивного поведения повторялись почти каждый раз. Наиболее яркий из этих случаев был связан с попыткой задушить жену, которая спала рядом (больному приснилось, что он спасает жену от змеи, которая обвила ее шею).
Первый эпизод снохождения наблюдался 11 лет назад во время летнего отдыха на море, когда, проснувшись ночью, он почувствовал сильное желание выйти из номера, открыл дверь, вышел, начал надевать обувь, стоявшую снаружи двери, и пришел в себя, недоумевая, как такое событие могло с ним приключиться. В течение 10 лет отмечает умеренные запоры с необходимостью приема слабительных средств 2—3 раза в месяц. Около 8 лет назад заметил ослабление обоняния (ранее хорошо распознавал оттенки запахов). Примерно с этого же времени стал отмечать легкое дрожание рук, преимущественно при позной нагрузке, выполнении повседневных действий (письме, приеме жидкой пищи, удерживании стакана). Около 5 лет назад обратил внимание на учащение позывов к мочеиспусканию днем.
С 2009 г. больной отмечает учащение вздрагиваний и связанных с ними ночных пробуждений. Что провоцирует приступы, назвать не может.
Около 9 мес назад жену стало беспокоить усиление двигательной активности пациента во сне, которая соответствовала устрашающему сюжету сновидений. Жена обратила также внимание на ухудшение осанки в виде появления легкой сутулости (ранее пациент отличался правильной осанкой). У пациента стало возникать ощущение скованности в области шеи и спины. Изменился характер дрожания рук в виде присоединения периодически возникающего дрожания большого пальца (чаще в правой кисти), иногда дрожание руки возникало при ходьбе в свободно свисающей кисти правой руки.
Был проконсультирован психотерапевтом, который назначил больному венлафаксин 150 мг/сут (принимал около 3 мес), хлорпротиксен 5 мг/сут. На фоне терапии наблюдался незначительный положительный клинический эффект в виде снижения частоты ночных двигательных приступов, однако усилилось дрожание рук.
Около месяца назад произошел второй эпизод снохождения, напугавший пациента и его жену: больной ночью встал для мочеиспускания, попытался выйти из комнаты, не ответил на вопрос жены, спросившей, куда он идет, затем сел на стул, посидел некоторое время и вернулся обратно в постель. Наутро об эпизоде ночного вставания не помнил.
В связи с сохраняющимися приступами двигательной активности ночью, усилением дрожания рук пациент обратился к неврологу в Клинику нервных болезней им. А.Я. Кожевникова. Были рекомендованы отмена хлорпротиксена, а также дальнейшее неврологическое, сомнологическое и нейропсихологическое обследование.
Из анамнеза жизни.
Раннее моторное и психическое развитие без особенностей. Академическая успеваемость в школе была хорошая. В детстве занимался лыжным спортом. Получил специальность экономиста. Два раза служил в армии (по контракту) с общим стажем 20 лет. В настоящее время работает менеджером. Вредные привычки отрицает. Женат. Живет с семьей. Имеет двух здоровых детей.
Перенесенные заболевания
: гепатит, А в возрасте 17 лет. Аденома предстательной железы с 2001 г., проявляется легкими затруднениями инициации мочеиспускания, слабой струей при мочеиспускании. В 2011 г. проведено эндопротезирование левого тазобедренного сустава.
Наследственный анамнез:
продолжительность жизни дедушек и бабушек около 85 лет. Мать умерла в возрасте 89 лет от рака груди. Отец жив, 93 года. У матери пациента отмечалось дрожание рук с 70 лет, у сестры матери — дрожание головы с 50—55 лет. У отца отмечается дрожание рук в течение последних 10—15 лет без значимой замедленности движений.
Соматический статус.
Рост 176 см, масса тела 88 кг, индекс массы тела 28,4 кг/м2. Окружность шеи 37 см. Объем талии 104 см. Кожные покровы нормальной окраски. Дыхание везикулярное, хрипов нет. Тоны сердца нормальной звучности, ритмичные, артериальное давление 110/70 мм рт.ст., частота сердечных сокращений 72 уд/мин. Язык влажный. Живот мягкий, безболезненный, печень определяется по краю реберной дуги.
Неврологический статус
. В сознании, контактен. Ориентирован в месте и времени. При исследовании функции черепных нервов нарушений не выявлено. Оживление хоботкового рефлекса. Парезы отсутствуют. Карпорадиальный рефлекс и рефлексы с бицепса, трицепса, коленные симметричны, средней живости; ахилловы рефлексы несколько снижены, симметричны. Патологические рефлексы отсутствуют. Чувствительность не нарушена. Координаторные пробы выполняет удовлетворительно.
Мелкоамплитудный постурально-кинетический тремор в кистях рук, симметричный. Непостоянный тремор покоя в большом пальце правой кисти. Провокацией тремора покоя в правой руке являются эмоциональное волнение, динамическая нагрузка на левую руку. Непостоянно выявляемые легкая мышечная ригидность в левой руке, феномен зубчатого колеса. Минимальная гипокинезия в левой руке и левой стопе при выполнении динамических проб (последовательное соединение и разъединение большого и указательного пальцев кисти, сжимание—разжимание кисти в кулак, пронация—супинация кистей рук, постукивание пяткой ноги по полу). Тенденция к сгибательной позе (небольшая сутулость). Походка не изменена. Гипохейрокинез слева, непостоянный мелкоамплитудный тремор правой кисти в свободно свисающей руке при ходьбе.
Оценка эмоционально-аффективных нарушений
: по шкале депрессии Бека — 8 баллов (депрессия отсутствует), по опроснику тревоги Спилбергера — 35 баллов (умеренная тревожность).
Сомнологический статус.
Вечером ложится в постель в 23:00, встает в 7:00 в рабочие и выходные дни. Засыпает быстро, в среднем около 5 мин. Ночные пробуждения случаются 1—2 раза за ночь (встает в туалет). После них засыпает быстро. Почти каждую ночь (5—7 ночей в неделю) через 1,5—2 ч после засыпания наблюдается повышенная двигательная активность: от отдельных вздрагиваний с жестикуляцией до сложных движений с нанесением ударов. Отмечает частые сновидения угрожающего характера. Качеством ночного сна удовлетворен. Дневная сонливость отсутствует.
Результаты дополнительных методов обследования
Общий анализ крови, биохимический анализ крови, общий анализ мочи
: без отклонений показателей от нормальных значений.
Нейропсихологическое обследование (заключение психолога): выявленные симптомы можно рассматривать в рамках легких когнитивных расстройств. Однако характер выявленных нарушений памяти не позволяет исключить признаки первичных (гиппокампальных) мнестических нарушений, что может свидетельствовать о проявлениях самой начальной стадии сопутствующего нейродегенеративного процесса, в том числе альцгеймеровского характера. Для окончательного уточнения характера нарушений требуется динамическое наблюдение за пациентом и повторное нейропсихологическое обследование.
Компьютерная томография головного мозга
: органических изменений в головном мозге не выявлено.
Эпвортская шкала дневной сонливости
— 0 баллов (норма менее 10 баллов); анкета скрининга синдрома обструктивного апноэ сна (СОАС) — 1 балл (норма менее 4 баллов); анкета качества сна — 16 баллов (норма 22 балла и более), нарушение сна; анкета расстройства поведения в быстром сне (RBD1Q) — 1 балл (норма 0 баллов); анкета расстройства поведения в быстром сне — 11 баллов (норма до 5 баллов), вероятное РПБС.
Для верификации диагноза больному в условиях палаты стационара было проведено ночное ПСГ-исследование с регистрацией следующих показателей: 6 каналов электроэнцефалограммы (ЭЭГ) в монополярных отведениях — Fp1A1, Fp2A2, C3A1, C4A2, O1A1, O2A2, 2 канала электроокулограммы, 1 канал подбородочной ЭМГ, 2 канала ЭМГ передних большеберцовых мышц, 1 канал электрокардиографии, регистрация показателей дыхания во сне с записью ороназального потока воздуха, дыхательных движений грудной стенки, шума дыхания, уровня насыщения крови кислородом (сатурация) и положения тела в постели (без адаптационной ночи). Расшифровка производилась согласно рекомендациям Американской академии медицины сна 2007 г. в модификации 2012 г. [13].
Больной прибыл в стационар в 21:00. В 22:45 в палате был выключен свет. Исследование закончено в 7:30. Результаты исследования представлены на рис. 1.
Рис. 1. Гипнограмма пациента С. W — бодрствование; REM — ФБС; N1, 2, 3 — соответствующие стадии ФМС; ДК — движения конечностей (определяется по изменению ЭМГ передних большеберцовых мышц с двух сторон). По горизонтальной оси отложено время суток.
Время засыпания составило 35,5 мин, общее время сна — 6,2 ч, количество пробуждений из сна — 85, время бодрствования в период сна — 119 мин. Индекс эффективности сна — 65,3%. Латентный период 1-й стадии сна длился 35,5 мин, 2-й стадии — 36,0 мин, ФБС — 72,5 мин. Продолжительность 1-й стадии сна составила 4,0 мин (0,8%), 2-й стадии — 274,5 мин (55,5%), 3-й стадии — 0 мин, ФБС — 96,5 мин (19,5%). Индекс периодических движений конечностей — 19,5 эпизода в час.
На фоне эпизодов храпа у пациента во время сна регистрировались единичные эпизоды расстройств дыхания во сне (индекс дыхательных расстройств 1,6 эпизода в час при норме до 5 эпизодов в час) и связанные с ними эпизоды десатурации (индекс десатурации 1,6 эпизода в час).
Заключение по результатам ПСГ:
продолжительность ночного сна снижена. Структура сна изменена за счет увеличения времени засыпания, числа пробуждений, времени бодрствования внутри сна. Глубокий (3-я стадия) медленный сон отсутствует. На фоне эпизодов храпа клинически значимого числа эпизодов расстройств дыхания во сне и связанных с ними десатураций не выявлено. В ФБС на фоне отсутствия мышечной атонии регистрируются разнообразные формы двигательной активности от отдельных вздрагиваний с жестикуляцией до сложных движений с попытками нанесения ударов (рис. 2).
Рис 2. Полисомнограмма больного С. во время одного из эпизодов избыточной преходящей мышечной активности. Зарегистрирована на каналах ЭМГ правой и левой малоберцовых мышц (указано стрелкой). Эпоха анализа соответствует ФБС: на 2 верхних каналах электроокулограммы отмечается наличие быстрых движений глаз (указано двумя стрелками), преобладает активность ЭЭГ в тета- и альфа-диапазонах (6 следующих каналов ЭЭГ). По данным ЭМГ подбородочных мышц (следующий канал) мышечная активность имеет относительно высокую амплитуду, характерную для других стадий сна, но не для ФБС. Первый эпизод расстройства поведения зарегистрирован в 05:10, когда пациент резко приподнялся в кровати, жестикулировал руками и разговаривал. Во время приступа на ЭЭГ отмечались артефакты, связанные с движением, после окончания которых сон продолжился в ФБС.
Второй эпизод РПБС был зафиксирован через 3 мин от предыдущего. Пациент ударил правой ногой по кровати, жестикулировал правой рукой. Во время приступа на ЭЭГ также регистрировались артефакты, связанные с движением, после чего сон продолжился в ФБС.
Наиболее яркий эпизод РПБС был зарегистрирован в 05:15. Больной приподнялся в кровати, стал совершать сначала хаотичные, затем ударообразные движения верхними конечностями, после чего проснулся.
Эффект специфического лечения
В связи с тем что у больного были выявлены клинические и ПСГ-признаки парасомнии в форме РПБС, для устранения приступов ему был назначен клоназепам в дозе 1 мг на ночь. На фоне приема препарата пациент и его супруга отметили, что частота приступов значительно уменьшилась (примерно на 70%), а сами эпизоды стали не такими интенсивными и беспокоящими окружающих. Вместо развернутого двигательного акта приступ парасомнии сохраняется в виде подергиваний отдельных групп мышц.
Обсуждение
На основании характерной клинической картины, подтвержденной результатами ПСГ, у пациента было диагностировано РПБС. Имевшие место дважды эпизоды хождения во сне соответствуют клиническим критериям снохождения — парасомнии из группы расстройств пробуждения. Это подтверждают следующие проявления: наличие повторяющихся эпизодов неполного пробуждения от сна; отсутствие отклика при попытках вступить с пациентом в контакт; отсутствие у пациента во время эпизода осознания происходящего; амнезия эпизода наутро; невозможность объяснить расстройство наличием другого нарушения сна, психическим заболеванием, приемом лекарственных или других препаратов [4].
У пациента имеются и другие заболевания. Наследственная отягощенность со стороны матери и отца пациента по эссенциальному тремору, симметричный постурально-кинетический тремор в руках стали основанием постановки диагноза «эссенциальный тремор». В то же время наличие минимальной гипокинезии при выполнении динамических проб, тремора покоя в правой руке, минимальной ригидности в левой руке у больного позволили диагностировать синдром паркинсонизма. Сочетание паркинсонизма с признаками, поддерживающими диагноз БП [14], тремором покоя, асимметричным началом паркинсонизма, а также характерными для БП ранними недвигательными симптомами (РПБС, запоры, гипосмия, гиперактивный мочевой пузырь), наряду с отсутствием атипичных для БП признаков, позволяют сделать заключение о наличии у него БП (1,0 стадия по шкале тяжести Hoehn—Yahr — преимущественно односторонняя симптоматика). В результате можно сформулировать полный диагноз пациента: 1,0 стадия Б.П. Эссенциальный тремор. Расстройство поведения в быстром сне. Снохождение.
Отсутствие регрессии гипокинезии и тремора покоя на фоне отмены нейролептика также свидетельствует в пользу наличия у больного именно первичного паркинсонизма. В дополнение к назначенному лечению по поводу РПБС для коррекции минимальных симптомов паркинсонизма, с учетом также возможного нейропротективного эффекта препарата [15] ему были рекомендованы прием ингибитора МАО-B разагилина в дозе 1 мг/сут, лечебная гимнастика и усиление двигательной активности.
Таким образом, неврологическое обследование пациента, основными жалобами которого являлись расстройства сна, позволило не только уточнить их характер и подобрать симптоматическую терапию, но и выявить двигательные экстрапирамидные нарушения, соответствующие критериям диагностики БП и эссенциального тремора. Представленный случай отличается рядом синдромологических, феноменологических и нозологических сочетаний. Так, началу двигательных симптомов БП предшествовали проявления эссенциального тремора. Вопросы сочетания БП и эссенциального тремора в настоящее время находятся в фокусе внимания исследователей [16]. Результаты исследования R. Feketa и соавт. [17] показали, что у 12% больных с эссенциальным тремором в течение 5 лет наблюдения появлялись симптомы Б.П. Ассоциация эссенциального тремора с дрожательным вариантом БП предполагает общность патофизиологических процессов заболеваний. Обнаружено, что риск эссенциального тремора выше у родственников пациентов с дрожательной и смешанной формой в сравнении с акинетико-ригидной формой болезни [18]. Уточняются общие генетические патофизиологические механизмы развития БП и эссенциального тремора [19]. Стоит упомянуть, что РПБС иногда может предшествовать и эссенциальному тремору, но сравнительные исследования недвигательных расстройств, связанных с БП и эссенциальным тремором [20], свидетельствуют о более редкой ассоциации эссенциального тремора с РПБС, как и другими симптомами додвигательной стадии БП (гипосмия, гиперактивный мочевой пузырь, нарушения памяти).
Нарушения сна, послужившие поводом обращения пациента за медицинской помощью, представлены сочетанием двух форм парасомний. Кроме того, у больного выявлены субклинические инсомнические расстройства в виде изменений структуры сна по данным ПСГ. Инсомния в виде сокращения продолжительности и качества ночного сна за счет удлинения времени засыпания, увеличения числа пробуждений, времени бодрствования внутри сна является самым распространенным видом нарушений сна у пациентов с БП и встречается у 60—98% больных [21—23]. В основе инсомнии при БП могут лежать первичные факторы, обусловленные нейродегенерацией структур мозга, участвующих в регуляции сна, циркадианные нарушения, а также вторичные факторы — двигательные и недвигательные симптомы БП [22—23]. В отсутствие клинически значимых вторичных факторов (депрессия, ночная гипокинезия, сенсорные, никтурические расстройства) в вышеописанном случае можно предполагать большую значимость первичных факторов нарушений сна. Результаты ПСГ пациента согласуются с данными недавней работы S. Joy. и соавт. [24], где у пациентов с начальной стадией БП, не получающих противопаркинсонические препараты, были выявлены изменения в ФМС (частые пробуждения, уменьшение общей продолжительности сна, особенно его глубоких стадий — 3-й и 4-й). Схожие данные о редукции ФМС были получены в ходе изучения нарушений сна при БП на экспериментальной модели раннего паркинсонизма [25].
Наряду с высокой распространенностью инсомнии, относительно часто встречающимся РПБС при БП, снохождение является весьма редким феноменом при этом заболевании. Снохождение у больных БП, главным образом в сочетании с другими видами парасомний, обсуждается в единичных публикациях. Так, в результате клинического обследования 417 пациентов с БП методом анкетирования, осуществленного N. Di Fabio и соавт. [26], снохождение выявлено у 9% больных, из них у 5% оно возникло впервые. У 8 из 10 больных с этой парасомнией при ПСГ также были выявлены признаки РПБС. В исследовании A. Ylikoski и соавт. [27], включавшем пациентов с БП (n
=661), которые прошли анкетирование, снохождение (во всех случаях в ассоциации с РПБС) было обнаружено у 1,8%. Таким образом, снохождение является редким феноменом при БП, однако оно встречается у пациентов с БП чаще, чем в общей популяции. Следовательно, сочетание двух форм парасомнии (снохождение и РПБС) у представленного пациента является редким, но не невозможным феноменом, по-видимому, отражающим комплексную природу нейродегенеративного процесса при БП, который затрагивает механизмы генерации как медленного, так и быстрого сна.
Имеются данные о связи РПБС с более тяжелым течением БП, быстрым прогрессированием умеренных когнитивных нарушений, развитием деменции, присоединением зрительных галлюцинаций [28—29]. Выявлена ассоциация этой парасомнии с большей степенью ухудшения повседневной активности и снижения оценки качества жизни, а также ускоренным прогрессированием гиперсомнии, депрессии, никтурии [8].
По данным N. Di Fabio и соавт. [26], пациенты со снохождением отличались от пациентов без парасомний большей частотой депрессии, тревоги, тяжестью двигательных симптомов БП и худшими показателями повседневной активности. Однако различий по этим характеристикам у больных со снохождением от пациентов с изолированным (без снохождения) РПБС получено не было.
Начало РПБС на додвигательной стадии развития БП у пациента в представленном клиническом случае, значительная степень клинической выраженности феномена могут рассматриваться в качестве маркера раннего распространения нейродегенеративного процесса на ствол мозга, что является основой для возможного неблагоприятного дальнейшего течения заболевания с развитием и других недофаминергических (или не исключительно дофаминергических) недвигательных симптомов заболевания [8]. Таким образом, диагностика БП и объективизация РПБС представляется значимой в контексте прогнозирования закономерностей дальнейшего течения БП, необходимости наблюдения пациента (с мониторингом когнитивных и других нервно-психических нарушений) с целью своевременного проведения профилактики и терапии сопутствующих симптомов заболевания.
Данные анамнеза этого пациента демонстрируют, как отсутствие правильной оценки имеющихся нарушений сна и экстрапирамидных нарушений способствовало назначению неадекватной, потенциально опасной тактики терапии. Назначение венфлаксина и хлорпротиксена способствовало обратимому усилению тремора, что можно объяснить как нежелательным эффектом антидепрессанта — ингибитора обратного захвата серотонина и норадреналина, так и нейролептика. По данным литературы, с назначением антидепрессантов может быть связано усиление также и проявлений РПБС. Кроме того, назначение нейролептика пациенту с уже имеющимся синдромом паркинсонизма может рассматриваться как врачебная ошибка. В свете новых данных о том, что прием нейролептика может не только вызывать лекарственный паркинсонизм, но и способствовать увеличению риска развития БП в 3,2 раза [30], назначению препаратов этой группы пациенту старшего возраста должно предшествовать тщательное неврологическое обследование для исключения экстрапирамидной недостаточности. Группу риска возникновения ятрогенного паркинсонизма частично формируют пациенты с субклинической стадией или начальными нераспознанными клиническими проявлениями БП [31]. Альтернативой назначенному пациенту клоназепаму с целью коррекции РПБС является мелатонин 2—6 мг на ночь [1, 5, 32], в случае сочетания РПБС с выраженными когнитивными нарушениями могут рекомендоваться ингибиторы ацетилхолинэстеразы [33].
Таким образом, проявления парасомний (РПБС и снохождение), с одной стороны, способствовали ранней диагностике БП до развития дезадаптирующих двигательных симптомов болезни, поскольку привлекли внимание врачей своей необычностью, с другой — наличие этих сопутствующих состояний явилось основанием для уточнения тактики лечения БП и эссенциального тремора с исключением препаратов, провоцирующих развитие двигательных расстройств.
Авторы заявляют об отсутствии конфликта интересов.